新しいMoCRA有害事象の要件を満たす
レジストラの有害事象管理(AEM)ソフトウェアは、消費者の摂取から調査、FDAの報告および記録保管まで、有害事象プロセス全体を管理するターンキーソリューションです。
有害事象101はわずか2分で
レジストラの有害事象管理(AEM)ソフトウェアは、消費者の摂取から調査、FDAの報告および記録保管まで、有害事象プロセス全体を管理するターンキーソリューションです。

MoCRAには新しい厳格な要件があります有害事象:
MoCRAには有害事象に関する新しい厳格な要件があります。

- 一次包装と二次包装の両方に連絡先情報を表示する
- 消費者から詳細な個人情報および医療情報を収集する
- 有害事象が“重篤”なものか調査する
- 15営業日以内に“重篤な有害事象”をFDAに報告する
- すべての健康関連の有害事象を記録し、最長6年間記録を維持する
美容的有害事象専用
専用美容上の有害事象
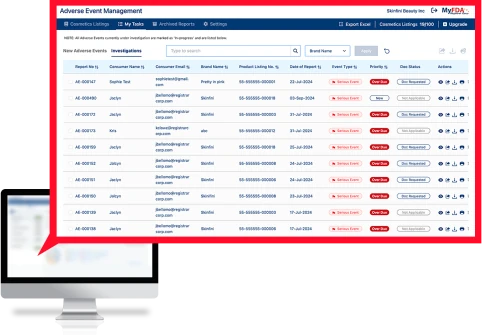
有害事象管理(AEM)ソフトウェアは、機密性の高い消費者医療データを安全に取り込み、全世界のすべての製品のすべての有害事象を追跡し、内部の利害関係者に情報を送信し、FDAに提出する重篤な有害事象をFDA MedWatchフォーマットにフォーマットします。





消費者に優しい摂取
消費者はデジタルフォームに記入し、ウェブリンクまたは製品ラベルのQRコードを通じて最大43のデータを内密に提出します。

即時アラートと迅速な対応
全SKUの有害事象をリアルタイムでグローバルに監視し、潜在的な安全性または品質の問題の最も早い指標を取得します。
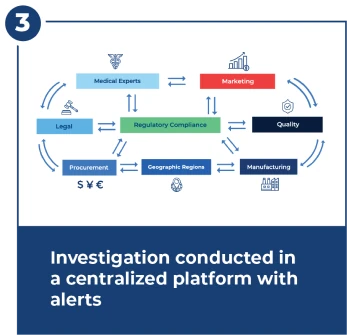
FDAの15日以内の期限の調査
調査は複雑で、多くのチーム間で密接かつ迅速に調整する必要があります。調査センターは、ワークフロー、アラート、ダッシュボード、集中型文書管理を提供します。

Denver Healthと提携し、有害事象報告と規制コンプライアンスを合理化します。

リアルタイムアラート

ワークフロー

ダッシュボード

文書管理
FDA MedWatch対応
重篤な有害事象報告 MedWatch 3500Aにフォーマット済み 迅速に提出できます。

ワールドクラスのデータセキュリティ
医療および個人識別情報(PII)の保管および送信に関するISO 27001認証のセキュリティ。

MoCRA有害事象ガイド
エグゼクティブブリーフカバー:
- 有害事象に関する5つの主要要件
- コンプライアンス違反によるビジネスおよび法的リスク
- 既存プロセスのギャップ
- 要件を満たすための推奨事項
MoCRAに準拠していますか?
有害事象の専門家との短い電話の予定を立ててください。
遵守してるのは確かですか?
当社とのショートコールの予定を立てる有害事象の専門家。
有害事象について知っておくべきこと
知っておくべきこと有害事象について
MoCRA有害事象報告コンプライアンスのナビゲート方法について、化粧品専門家から学びましょう。

完全な有害事象イベントガイド


