不良事件 101 仅需 2 分钟。
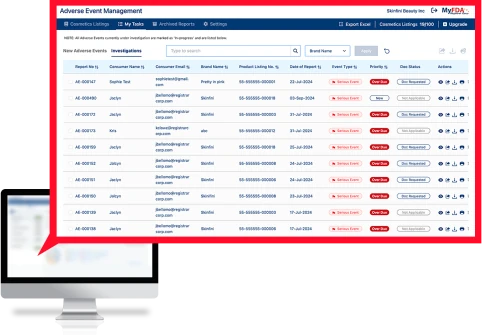
“注册商”的不良事件管理 (AEM) 软件是一个交钥匙解决方案,用于管理从消费者接收到调查再到 FDA 报告和记录存储的整个不良事件流程。

MoCRA
对不良事件有新的严格要求:
MoCRA 对不良事件有新的严格要求:

- 在初级包装和次级包装上显示联系信息
- 从消费者处收集详细的个人和医疗信息
- 调查以确定不良事件是否为“严重”事件
- 在 15 个工作日内向 FDA 报告“严重不良事件”
- 记录所有健康相关不良事件,并保存记录长达 6 年
专为化妆品不良事件而设计
专为
化妆品不良事件而设计
不良事件管理 (AEM) 软件可安全地获取敏感的消费者医疗数据,跟踪全球所有产品的所有不良事件,将信息传输给内部利益相关者,并将严重不良事件格式化为 FDA MedWatch 格式以提交给 FDA。





消费者友好型入口
消费者填写数字表格,通过网络链接或产品标签上的二维码秘密提交最多 43 个数据字段。

即时警报&快速响应
实时监测全球每个 SKU 的不良事件,并尽早发现潜在的安全或质量问题。
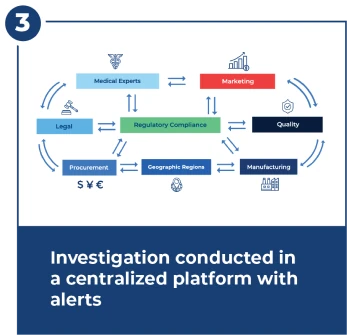
在 15 天 FDA 截止日期内调查
调查很复杂,需要多个团队之间紧密而快速的协调。调查中心提供工作流、警报、仪表板和集中式文档管理。

实时警报

工作流程

仪表板

文件管理
FDA MedWatch 就绪
严重不良事件报告 预格式化为 MedWatch 3500A 以便快速提交。

世界一流的数据安全
用于存储和传输医疗和个人可识别信息 (PII) 的 ISO 27001 认证安全性。

您确定自己符合 MoCRA 标准吗?
安排与我们的不良事件专家进行简短通话。
你确定你是合规的吗?
安排与我们的
不良事件专家进行简短通话。
您需要了解的有关不良事件的所有信息
您需要了解的
有关不良事件的所有信息
向我们的化妆品专家学习如何浏览报告合规性的 MoCRA 不良事件。

完成
不良事件指南


