Atender aos novos requisitos de eventos adversos do MoCRA
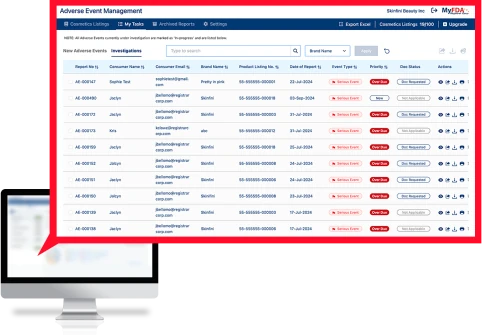
O software de gestão de eventos adversos (Adverse Events Management, AEM) da Registrar é uma solução pronta para uso para gerenciar todo o processo de eventos adversos, desde a ingestão do consumidor até a investigação e o armazenamento de relatórios e registros da FDA.
Eventos adversos 101 em apenas 2 minutos.
O software de gestão de eventos adversos (Adverse Events Management, AEM) da Registrar é uma solução pronta para uso para gerenciar todo o processo de eventos adversos, desde a ingestão do consumidor até a investigação e o armazenamento de relatórios e registros da FDA.

O MoCRA tem requisitos novos e rigorosos
para eventos adversos:
O MoCRA tem requisitos novos e rigorosos para eventos adversos:

- Exibir informações de contato na embalagem primária e na secundária
- Coletar informações médicas e pessoais detalhadas do consumidor
- Investigar para determinar se o evento adverso é um evento “sério”
- Relatar evento adverso “sério” à FDA em até 15 dias úteis
- Registrar todos os eventos adversos relacionados à saúde e manter registros por até 6 anos
Feito especificamente para eventos adversos cosméticos
Feito especificamente para eventos adversos
cosméticos
O software de gestão de eventos adversos (AEM) absorve com segurança dados médicos confidenciais do consumidor, rastreia todos os eventos adversos de todos os produtos globalmente, transmite informações para as partes interessadas internas e formata eventos adversos sérios no formato MedWatch da FDA para envio à FDA.





Ingestão amigável ao consumidor
O consumidor preenche o formulário digital para enviar confidencialmente até 43 campos de dados através do link da web ou código QR no rótulo do produto.

Resposta & rápida de alerta instantâneo
Monitore eventos adversos globalmente para cada SKU em tempo real e obtenha o indicador mais precoce de possíveis problemas de segurança ou qualidade.
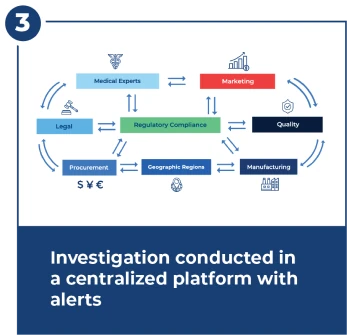
Investigar dentro do prazo de 15 dias da FDA
As investigações são complexas e exigem coordenação estreita e rápida entre muitas equipes. O centro de investigação fornece fluxos de trabalho, alertas, painéis e gerenciamento centralizado de documentos.

Alertas em tempo real

Fluxos de trabalho

Painéis

Gestão de documentos
FDA MedWatch Ready
Relatórios de eventos adversos sérios pré-formatado para o MedWatch 3500A para envio rápido.

Segurança de dados de nível internacional
Segurança certificada pela ISO 27001 para armazenamento e transmissão de informações médicas e pessoais identificáveis (PII).

Seu guia para eventos adversos do MoCRA
Capas do resumo executivo:
- 5 principais exigências para eventos adversos
- Riscos comerciais e legais de não conformidade
- Lacunas nos processos existentes
- Recomendações para atender aos requisitos
Tem certeza de que é compatível com MoCRA?
Agende uma breve ligação com nossos especialistas em eventos adversos.
Tem certeza de que está em conformidade?
Agende uma breve ligação com nossos especialistas em eventos
adversos.
Tudo o que você precisa saber sobre eventos adversos
Tudo o que você precisa saber
sobre eventos adversos
Aprenda com nossos especialistas em cosméticos sobre como navegar pela conformidade de relatórios de eventos adversos do MoCRA.

Guia completo de
eventos adversos


