Erfüllen Sie die neuen MoCRA-Anforderungen für unerwünschte Ereignisse
Die AEM-Software (Unerwünschte Ereignisse Management) von Registrar ist eine schlüsselfertige Lösung zur Verwaltung des gesamten Prozesses für unerwünschte Ereignisse von der Verbraucheraufnahme über die Untersuchung bis hin zur Berichterstattung und Aufbewahrung von Aufzeichnungen durch die FDA.
Unerwünschte Ereignisse 101 in nur 2 Minuten.
Die AEM-Software (Unerwünschte Ereignisse Management) von Registrar ist eine schlüsselfertige Lösung zur Verwaltung des gesamten Prozesses für unerwünschte Ereignisse von der Verbraucheraufnahme über die Untersuchung bis hin zur Berichterstattung und Aufbewahrung von Aufzeichnungen durch die FDA.

MoCRA hat neue, strenge Anforderungenfür unerwünschte Ereignisse:
MoCRA hat neue, strenge Anforderungen für unerwünschte Ereignisse:

- Kontaktinformationen sowohl auf der Primär- als auch auf der Sekundärverpackung anzeigen
- Sammeln Sie detaillierte persönliche und medizinische Informationen vom Verbraucher
- Untersuchen, um festzustellen, ob das unerwünschte Ereignis ein „schwerwiegendes“ Ereignis ist
- Meldung eines „schwerwiegenden“ unerwünschten Ereignisses an die FDA innerhalb von 15 Werktagen
- Aufzeichnung aller gesundheitsbezogenen unerwünschten Ereignisse und Aufbewahrung von Aufzeichnungen für bis zu 6 Jahre
Speziell für kosmetische unerwünschte Ereignisse entwickelt
Speziell entwickelt fürkosmetische unerwünschte Ereignisse
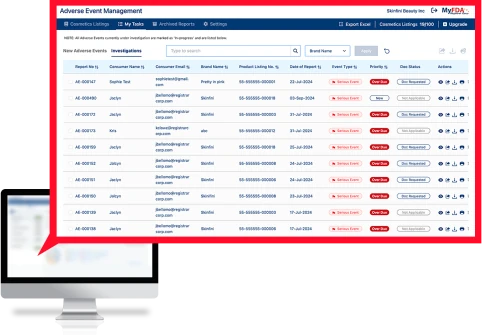
Die Adverse Events Management (AEM)-Software nimmt sensible medizinische Verbraucherdaten sicher auf, verfolgt alle unerwünschten Ereignisse für alle Produkte weltweit, überträgt Informationen an interne Stakeholder und formatiert schwerwiegende unerwünschte Ereignisse zur Einreichung bei der FDA in das FDA MedWatch-Format.





Verbraucherfreundliche Aufnahme
Der Verbraucher füllt das digitale Formular aus, um bis zu 43 Datenfelder über einen Weblink oder QR-Code auf dem Produktetikett vertraulich einzureichen.

Sofortige Warnung und schnelle Reaktion
Überwachen Sie unerwünschte Ereignisse weltweit für jede SKU in Echtzeit und erhalten Sie den frühesten Indikator für potenzielle Sicherheits- oder Qualitätsprobleme.
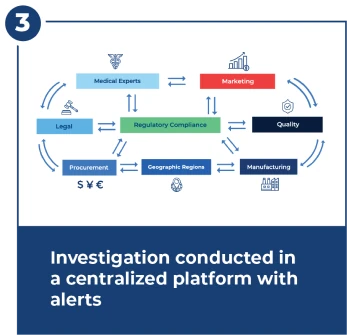
Untersuchung innerhalb von 15 Tagen nach der FDA-Frist
Untersuchungen sind komplex und erfordern eine enge und schnelle Koordination über viele Teams hinweg. Das Untersuchungszentrum bietet Workflows, Warnungen, Dashboards und ein zentralisiertes Dokumentenmanagement.

Zusammenarbeit mit Denver Health zur Rationalisierung der Meldung unerwünschter Ereignisse und der Einhaltung gesetzlicher Vorschriften.

Echtzeit-Warnungen

Workflows

Dashboards

Dokumentenverwaltung
FDA MedWatch bereit
Berichte über schwerwiegende unerwünschte Ereignisse vorformatiert auf die MedWatch 3500A zur schnellen Einreichung.

Erstklassige Datensicherheit
ISO 27001-zertifizierte Sicherheit für die Speicherung und Übertragung von medizinischen und personenbezogenen Daten (PII).

Ihr Leitfaden zu MoCRA-Unerwünschten Ereignissen
Kurzfassungen für Führungskräfte:
- 5 Hauptanforderungen für unerwünschte Ereignisse
- Geschäftliche und rechtliche Risiken der Nichteinhaltung
- Lücken in bestehenden Prozessen
- Empfehlungen zur Erfüllung von Anforderungen
Sind Sie sicher, dass Sie MoCRA-konform sind?
Vereinbaren Sie ein kurzes Gespräch mit unseren Experten für unerwünschte Ereignisse.
Sind Sie sicher, dass Sie konform sind?
Vereinbaren Sie ein kurzes Gespräch mit unseremExperten für unerwünschte Ereignisse.
Alles, was Sie über unerwünschte Ereignisse wissen müssen
Alles, was Sie wissen müssenÜber unerwünschte Ereignisse
Erfahren Sie von unseren Kosmetikexperten, wie Sie mit unerwünschten MoCRA-Ereignissen umgehen und die Compliance melden.

Vollständige unerwünschteLeitfaden für Veranstaltungen


