새로운 MoCRA 이상사례 요건 충족
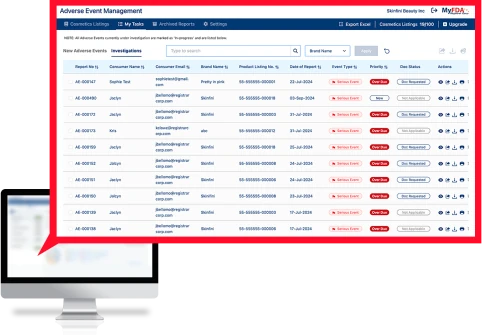
Registrar의 AEM(Adverse Events Management) 소프트웨어는 소비자 유입부터 조사, FDA 보고 및 기록 보관에 이르기까지 전체 부작용 프로세스를 관리하는 턴키 솔루션입니다.
단 2분 만에 이상반응 101.
Registrar의 AEM(Adverse Events Management) 소프트웨어는 소비자 유입부터 조사, FDA 보고 및 기록 보관에 이르기까지 전체 부작용 프로세스를 관리하는 턴키 솔루션입니다.

MoCRA에는 새롭고 엄격한 요구 사항이 있습니다.이상사례의 경우:
MoCRA는 이상반응에 대한 새롭고 엄격한 요건을 가지고 있습니다.

- 1차 및 2차 포장 모두에 연락처 정보 표시
- 소비자로부터 상세한 개인 및 의료 정보 수집
- 이상반응이 “중대한” 이상반응인지 확인하기 위해 조사한다.
- 영업일 기준 15일 이내에 “중대한” 이상반응을 FDA에 보고한다.
- 모든 건강 관련 이상반응을 기록하고 최대 6년 동안 기록을 유지한다.
미용 부작용을 위해 특별히 제작되었습니다.
다음을 위해 특별히 제작됨화장품 부작용
이상반응 관리(AEM) 소프트웨어는 민감한 소비자 의료 데이터를 안전하게 수집하고, 전 세계 모든 제품의 모든 이상반응을 추적하며, 내부 이해관계자에게 정보를 전송하고, FDA에 제출할 중대한 이상반응을 FDA MedWatch 형식으로 포맷합니다.





소비자 친화적 섭취
소비자가 디지털 양식을 작성하여 제품 라벨의 웹 링크 또는 QR 코드를 통해 최대 43개의 데이터 필드를 기밀로 제출합니다.

즉각적인 알림 및 빠른 응답
모든 SKU에 대해 실시간으로 전 세계적으로 부작용을 모니터링하고 잠재적인 안전 또는 품질 문제를 가장 빨리 파악할 수 있습니다.
FDA 마감일 15일 이내 조사
조사는 복잡하며 많은 팀에서 긴밀하고 빠른 조정이 필요합니다. 조사 센터는 워크플로, 알림, 대시보드 및 중앙 집중식 문서 관리를 제공합니다.

Denver Health와 협력하여 부작용 보고 및 규정 준수를 간소화합니다.

실시간 알림

워크플로

대시보드

문서 관리
FDA MedWatch 지원
중대한 이상반응 보고 MedWatch 3500A에 사전 포맷됨 빠르게 제출할 수 있습니다

세계적 수준의 데이터 보안
의료 및 개인 식별 정보(PII)의 저장 및 전송을 위한 ISO 27001 인증 보안.

MoCRA 이상반응에 대한 가이드
임원용 브리프 커버:
- 이상사례에 대한 5가지 주요 요건
- 규정 미준수로 인한 비즈니스 및 법적 위험
- 기존 프로세스의 격차
- 요구사항 충족을 위한 권장사항
MoCRA를 준수하는 것이 확실합니까?
이상반응 전문가와의 짧은 통화 일정을 잡으십시오.
순응도가 확실합니까?
당사와의 짧은 통화 예약이상사례 전문가.
이상반응에 대해 알아야 할 모든 것
알아야 할 모든 것이상사례 정보
MoCRA 부작용 보고 규정 준수를 탐색하는 방법에 대해 화장품 전문가로부터 알아보십시오.

부작용 완료이벤트 가이드


