Soddisfare i nuovi requisiti per gli eventi avversi MoCRA
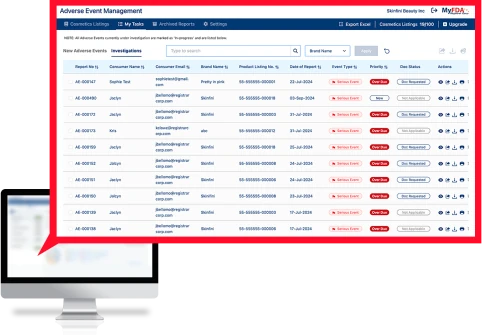
Il software AEM (Adverse Events Management) di Registrar è una soluzione chiavi in mano per gestire l’intero processo relativo agli eventi avversi, dall’accettazione da parte del consumatore all’indagine, fino alla segnalazione alla FDA e alla conservazione dei registri.
Eventi avversi 101 in soli 2 minuti.
Il software AEM (Adverse Events Management) di Registrar è una soluzione chiavi in mano per gestire l’intero processo relativo agli eventi avversi, dall’accettazione da parte del consumatore all’indagine, fino alla segnalazione alla FDA e alla conservazione dei registri.

MoCRA ha nuovi requisiti rigorosi
per gli eventi avversi:
MoCRA ha nuovi requisiti rigorosi per gli eventi avversi:

- Visualizzare le informazioni di contatto sia sulla confezione primaria che su quella secondaria
- Raccogliere informazioni personali e mediche dettagliate dal consumatore
- Indagare per determinare se l’evento avverso è un evento “grave”
- Segnalare l’evento avverso “grave” alla FDA entro 15 giorni lavorativi
- Registrare tutti gli eventi avversi correlati alla salute e conservare la documentazione per un massimo di 6 anni
Costruito appositamente per gli eventi avversi cosmetici
Costruito appositamente per gli eventi avversi
cosmetici
Il software di gestione degli eventi avversi (AEM) acquisisce in modo sicuro i dati medici sensibili dei consumatori, tiene traccia di tutti gli eventi avversi per tutti i prodotti a livello globale, trasmette le informazioni agli stakeholder interni e formatta gli eventi avversi gravi nel formato MedWatch della FDA per la presentazione alla FDA.





Assunzione a misura di consumatore
Il consumatore compila il modulo digitale per inviare in modo riservato fino a 43 campi di dati attraverso il link web o il codice QR sull’etichetta del prodotto.

Risposta & rapida all'allarme istantaneo
Monitora gli eventi avversi a livello globale per ogni SKU in tempo reale e ottieni il primo indicatore di potenziali problemi di sicurezza o qualità.
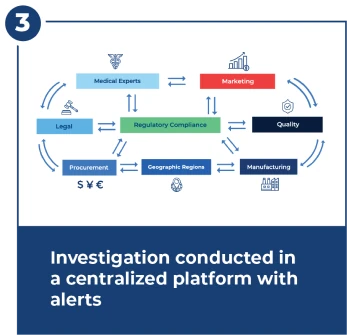
Indagare entro 15 giorni Scadenza FDA
Le indagini sono complesse e richiedono un coordinamento stretto e rapido tra molti team. Il centro di indagine fornisce flussi di lavoro, avvisi, dashboard e gestione centralizzata dei documenti.

Avvisi in tempo reale

Flussi di lavoro

Dashboard

Gestione dei documenti
FDA MedWatch pronto
Segnalazioni di eventi avversi gravi preformattato per MedWatch 3500A per un invio rapido.

Sicurezza dei dati di livello mondiale
Sicurezza certificata ISO 27001 per la conservazione e la trasmissione di informazioni mediche e personali identificabili (PII).

Guida agli eventi avversi MoCRA
Copertine Executive Brief:
- 5 requisiti chiave per gli eventi avversi
- Rischi aziendali e legali di non conformità
- Lacune nei processi esistenti
- Raccomandazioni per soddisfare i requisiti
Sei sicuro di essere conforme a MoCRA?
Pianifica una breve chiamata con i nostri esperti di eventi avversi.
Sei sicuro di essere conforme?
Pianifica una breve chiamata con i nostri esperti di eventi
avversi.
Tutto ciò che devi sapere sugli eventi avversi
Tutto ciò che devi sapere
sugli eventi avversi
Impara dai nostri esperti di cosmetica come navigare tra gli eventi avversi di MoCRA che segnalano la conformità.

Guida completa agli
eventi avversi


