Respecter les nouvelles exigences relatives aux événements indésirables du MoCRA
Le logiciel AEM (Adverse Events Management) de Registrar est une solution clé en main pour gérer l’ensemble du processus d’événements indésirables, de l’admission des consommateurs à l’enquête, en passant par le reporting et le stockage des dossiers de la FDA.
Événements indésirables 101 en seulement 2 minutes.
Le logiciel AEM (Adverse Events Management) de Registrar est une solution clé en main pour gérer l’ensemble du processus d’événements indésirables, de l’admission des consommateurs à l’enquête, en passant par le reporting et le stockage des dossiers de la FDA.

MoCRA a de nouvelles exigences strictespour les événements indésirables :
MoCRA a de nouvelles exigences strictes pour les événements indésirables :

- Afficher les coordonnées sur l’emballage primaire et secondaire
- Recueillir des informations personnelles et médicales détaillées auprès du consommateur
- Étudier pour déterminer si l’événement indésirable est un événement « grave »
- Signaler les événements indésirables « graves » à la FDA dans les 15 jours ouvrables
- Enregistrer tous les événements indésirables liés à la santé et conserver les dossiers pendant une durée maximale de 6 ans
Spécialement conçu pour les événements indésirables cosmétiques
Spécialement conçu pourÉvénements indésirables cosmétiques
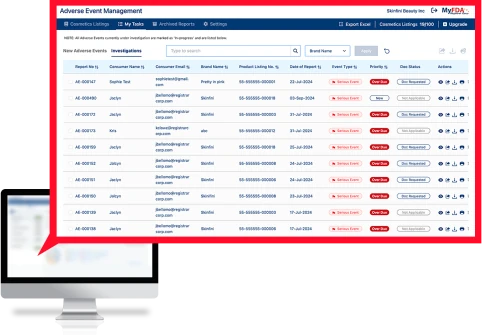
Le logiciel de gestion des événements indésirables (Adverse Events Management, AEM) collecte en toute sécurité les données médicales sensibles des consommateurs, suit tous les événements indésirables pour tous les produits à l’échelle mondiale, transmet des informations aux parties prenantes internes et formate les événements indésirables graves au format MedWatch de la FDA pour les soumettre à la FDA.





Prise d’air conviviale pour le consommateur
Le consommateur remplit le formulaire numérique pour soumettre en toute confidentialité jusqu’à 43 champs de données via un lien Web ou un code QR sur l’étiquette du produit.

Alerte instantanée et réponse rapide
Surveillez les événements indésirables à l’échelle mondiale pour chaque SKU en temps réel et obtenez le premier indicateur de problèmes potentiels de sécurité ou de qualité.
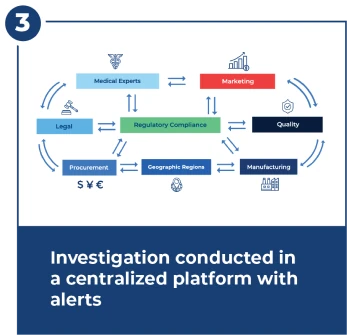
Enquêter dans les 15 jours de la date limite de la FDA
Les enquêtes sont complexes et nécessitent une coordination étroite et rapide entre de nombreuses équipes. Le centre d’investigation fournit des flux de travail, des alertes, des tableaux de bord et une gestion centralisée des documents.

Partenariat avec Denver Health pour rationaliser le signalement des événements indésirables et la conformité réglementaire.

Alertes en temps réel

Flux de travail

Tableaux de bord

Gestion des documents
FDA MedWatch Ready
Rapports d’événements indésirables graves préformaté sur la MedWatch 3500A pour une soumission rapide.

Sécurité des données de classe mondiale
Sécurité certifiée ISO 27001 pour le stockage et la transmission des informations médicales et personnelles identifiables (PII).

Votre guide des événements indésirables liés au MoCRA
Couvertures du résumé exécutif :
- 5 exigences clés pour les événements indésirables
- Risques commerciaux et juridiques de non-conformité
- Écarts dans les processus existants
- Recommandations pour répondre aux exigences
Êtes-vous sûr d’être conforme au MoCRA ?
Planifiez un bref appel avec nos experts en événements indésirables.
Êtes-vous sûr d’être conforme ?
Planifiez un bref appel avec notreExperts en événements indésirables.
Tout ce que vous devez savoir sur les événements indésirables
Tout ce que vous devez savoirÀ propos des événements indésirables
Apprenez de nos experts en cosmétiques comment gérer les événements indésirables liés au MoCRA et signaler la conformité.

Indésirable completGuide des événements


