Cumplir los nuevos requisitos de acontecimientos adversos de MoCRA
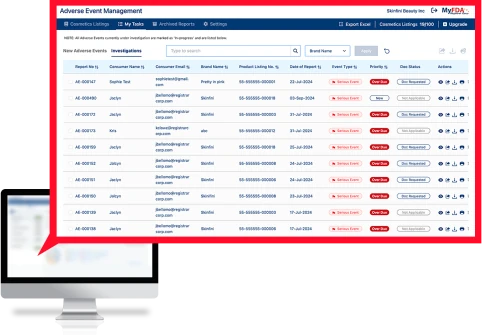
El software de gestión de eventos adversos (AEM) del registrador es una solución llave en mano para administrar todo el proceso de eventos adversos, desde la admisión del consumidor hasta la investigación, la creación de informes y el almacenamiento de registros de la FDA.
Acontecimientos adversos 101 en solo 2 minutos.
El software de gestión de eventos adversos (AEM) del registrador es una solución llave en mano para administrar todo el proceso de eventos adversos, desde la admisión del consumidor hasta la investigación, la creación de informes y el almacenamiento de registros de la FDA.

MoCRA tiene requisitos nuevos y estrictospara acontecimientos adversos:
MoCRA tiene requisitos nuevos y estrictos para los acontecimientos adversos:

- Mostrar la información de contacto tanto en el embalaje principal como en el secundario
- Recopilar información personal y médica detallada del consumidor
- Investigar para determinar si el acontecimiento adverso es un acontecimiento “grave”
- Notificar el acontecimiento adverso “grave” a la FDA en un plazo de 15 días hábiles
- Registrar todos los acontecimientos adversos relacionados con la salud y mantener registros durante un máximo de 6 años
Diseñado específicamente para acontecimientos adversos cosméticos
Diseñado específicamente paraAcontecimientos adversos cosméticos
El software de gestión de acontecimientos adversos (AEM) toma de forma segura datos médicos confidenciales de los consumidores, realiza un seguimiento de todos los acontecimientos adversos de todos los productos a nivel mundial, transmite información a las partes interesadas internas y formatea los acontecimientos adversos graves al formato MedWatch de la FDA para su presentación a la FDA.





Ingesta fácil para el consumidor
El consumidor rellena el formulario digital para enviar de forma confidencial hasta 43 campos de datos a través de un enlace web o un código QR en la etiqueta del producto.

Alerta instantánea y respuesta rápida
Supervisa los acontecimientos adversos a nivel mundial para cada SKU en tiempo real y obtén el primer indicador de posibles problemas de seguridad o calidad.
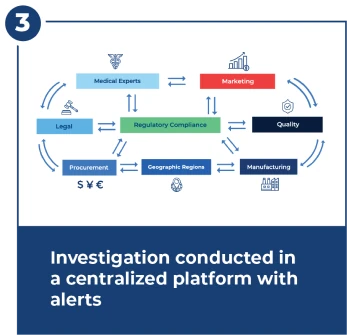
Investigar dentro del plazo límite de 15 días de la FDA
Las investigaciones son complejas y requieren una coordinación estrecha y rápida entre muchos equipos. El centro de investigación proporciona flujos de trabajo, alertas, paneles y gestión centralizada de documentos.

Colaboración con Denver Health para agilizar la notificación de acontecimientos adversos y el cumplimiento normativo.

Alertas en tiempo real

Flujos de trabajo

Paneles de control

Gestión de documentos
Listo para MedWatch de la FDA
Informes de acontecimientos adversos graves preformateado al MedWatch 3500A para un envío rápido.

Seguridad de datos de primera clase
Seguridad con certificación ISO 27001 para el almacenamiento y la transmisión de información médica y de identificación personal (IIP).

Su guía de acontecimientos adversos de MoCRA
Portadas del resumen ejecutivo:
- 5 requisitos clave para los acontecimientos adversos
- Riesgos comerciales y legales del incumplimiento
- Brechas en los procesos existentes
- Recomendaciones para cumplir los requisitos
¿Está seguro de que cumple con MoCRA?
Programe una breve llamada con nuestros expertos en acontecimientos adversos.
¿Está seguro de que cumple con la normativa?
Programe una breve llamada con nuestroExpertos en acontecimientos adversos.
Todo lo que necesita saber sobre los acontecimientos adversos
Todo lo que necesita saberAcerca de los acontecimientos adversos
Aprenda de nuestros expertos en cosmética cómo navegar por el cumplimiento de la notificación de acontecimientos adversos de MoCRA.

Completar adversoGuía de eventos


