Apprendre à obtenir l’approbation de la FDA, ou si vous en avez besoin, dépend du type de produit que vous commercialisez aux États-Unis. La FDA n’exige pas que tous les types de produits soient approuvés. Dans certains cas, seuls certains ingrédients doivent être approuvés.
Lisez la suite pour savoir quels secteurs et produits réglementés nécessitent l’approbation de la FDA et comment les obtenir si nécessaire.
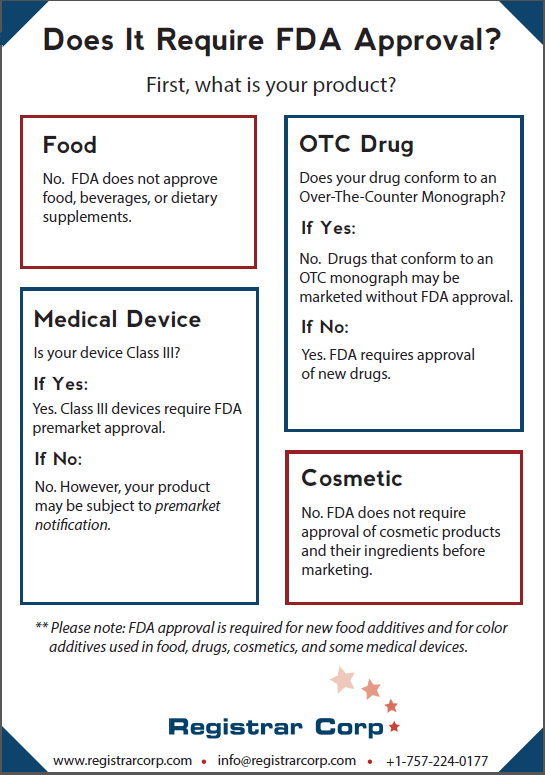
Approbation par la FDA des aliments, boissons et compléments alimentaires
La FDA n’approuve aucun aliment, boisson ou complément alimentaire. Les établissements alimentaires n’ont pas besoin de certification ou d’approbation avant de distribuer des produits aux États-Unis.
La plupart des établissements alimentaires doivent s’enregistrer auprès de la FDA et rester conformes à la loi sur la modernisation de la sécurité alimentaire (FSMA), mais être enregistrés et rester en conformité n’indique pas que l’établissement ou ses produits sont approuvés par la FDA. L’enregistrement des installations alimentaires de la FDA a deux objectifs principaux :
Tout d’abord, il fournit à l’agence les coordonnées nécessaires pour la communication de routine et d’urgence. Deuxièmement, il informe la FDA des produits et activités d’un établissement. Cela permet à la FDA de définir un calendrier d’inspection basé sur les risques potentiels pour la sécurité alimentaire.
L’une des rares exceptions à l’approbation de la FDA pour les produits alimentaires, les boissons et les compléments alimentaires est les additifs alimentaires. Les nouveaux additifs alimentaires nécessitent l’approbation de la FDA. Si un fabricant souhaite utiliser un nouvel additif alimentaire dans son produit, il devra le soumettre à des tests appropriés et prouver sa sécurité à la FDA.
Une autre exception potentielle concerne les compléments alimentaires qui prétendent traiter, diagnostiquer, prévenir ou guérir des maladies. Si une entreprise commercialise un complément alimentaire dans le cadre de l’une de ces revendications, il peut être soumis à la réglementation sur les médicaments et peut nécessiter l’approbation de la FDA s’il ne répond pas à certaines exigences (voir Approbation des médicaments par la FDA).
Approbation des médicaments par la FDA
Le fait qu’un nouveau médicament nécessite ou non l’approbation de la FDA dépend de la conformité du nouveau médicament à une monographie en vente libre (OTC). Les monographies en vente libre établissent des conditions dans lesquelles la FDA a prédéterminé qu’un médicament sera sûr et efficace.
Une fois qu’une monographie en vente libre est définitive, les établissements pharmaceutiques peuvent commercialiser des médicaments en vente libre conformes à la monographie sans avoir reçu l’approbation de la FDA. La FDA utilise également la discrétion de l’application pour permettre la commercialisation de certains médicaments sans approbation s’ils sont conformes aux monographies provisoires finales.
Cependant, si un nouveau médicament ne respecte pas une monographie, il nécessitera l’approbation de la FDA. Pour obtenir l’approbation de la FDA, les fabricants de médicaments doivent effectuer des tests cliniques en laboratoire, sur des animaux et sur des humains et soumettre leurs données à la FDA.
La FDA examinera ensuite les données et pourra approuver le médicament si l’agence détermine que les bénéfices du médicament l’emportent sur les risques pour l’utilisation prévue. La commercialisation d’un nouveau médicament qui n’est pas conforme à une monographie de gré à gré sans l’approbation de la FDA est considérée comme la commercialisation d’un nouveau médicament non approuvé, ce qui est un acte interdit en vertu de la loi sur les aliments, les médicaments et les cosmétiques (Food, Drug, and Cosmetic Act, FD&C Act).
Bien que la FDA approuve les nouveaux médicaments, l’agence n’approuve pas les médicaments composés. Les établissements pharmaceutiques doivent s’enregistrer auprès de la FDA et répertorier leurs produits, mais ni l’enregistrement ni la liste n’indiquent l’approbation de l’établissement ou de ses produits par la FDA.
Approbation des dispositifs médicaux par la FDA
La FDA place les dispositifs médicaux dans l’une des trois catégories basées sur les risques : Classe I, Classe II et Classe III. Les dispositifs de classe III sont les dispositifs les plus à risque et les seuls dispositifs qui nécessitent l’approbation préalable à la mise sur le marché de la FDA. Les fabricants de dispositifs de classe III doivent démontrer à la FDA que le dispositif fournit une assurance raisonnable de sécurité et d’efficacité.
Les dispositifs de classe I et II ne nécessitent pas l’approbation de la FDA. Ces dispositifs, à moins qu’ils ne soient exemptés en vertu de la loi FD&C Act, doivent plutôt soumettre une notification avant mise sur le marché (510(k)) à la FDA. L’objectif d’un 510(k) est de démontrer à la FDA que le dispositif est substantiellement équivalent (aussi sûr et efficace) à un dispositif déjà légalement commercialisé. Si la FDA détermine que le dispositif est effectivement substantiellement équivalent à un dispositif légalement commercialisé, l’agence autorise la commercialisation du produit plutôt que de l’approuver.
Les établissements de dispositifs doivent enregistrer et répertorier leurs dispositifs auprès de la FDA. Mais comme pour les aliments, les boissons, les compléments alimentaires et les médicaments, ni l’enregistrement ni la liste n’indiquent l’approbation par la FDA de l’établissement ou de ses dispositifs
Approbation des cosmétiques par la FDA
La FDA n’exige pas que les produits cosmétiques ou leurs ingrédients soient approuvés avant leur mise sur le marché. La seule exception concerne les additifs de couleur (voir Approbation FDA des additifs de couleur).
Avant 2022, les entreprises de cosmétiques n’avaient pas besoin de s’inscrire auprès de la FDA. Ils n’avaient besoin que de leurs produits pour être considérés comme sûrs pour leur utilisation prévue. Mais depuis que la récente loi sur la modernisation des réglementations cosmétiques (MoCRA) a été adoptée le 29 décembre 2022, la FDA a désormais une plus grande supervision de l’industrie cosmétique. Dans le cadre de cette nouvelle supervision, les sociétés de cosmétiques doivent désormais s’inscrire auprès de la FDA.
Encore une fois, l’enregistrement auprès de la FDA ne vaut pas l’approbation. L’enregistrement par la FDA d’une installation de cosmétiques ne donne à la FDA qu’un aperçu de l’installation et des produits qu’elle commercialise aux États-Unis.
Comme pour les compléments alimentaires, il existe une exception potentielle pour l’approbation des produits cosmétiques par la FDA. Certaines allégations faites dans l’étiquetage cosmétique peuvent amener la FDA à réguler un produit cosmétique en tant que médicament. Et dans certains cas, cela pourrait obliger le produit à demander l’approbation de la FDA (voir Approbation des médicaments par la FDA).
Approbation par la FDA des additifs de couleur
L’approbation est requise pour les additifs de couleur utilisés dans les aliments, les médicaments, les cosmétiques et certains dispositifs médicaux. Certaines couleurs à haut risque nécessitent également la certification de lot de couleurs FDA pour chaque lot individuel. Les additifs de couleur ne peuvent être utilisés que conformément à leurs utilisations, spécifications et restrictions approuvées.
Les produits qui contiennent des additifs de couleur non approuvés sont considérés comme falsifiés en vertu de la loi FD&C Act. Les produits adultérés ne peuvent pas être distribués dans le commerce interétatique aux États-Unis. Les produits cosmétiques présentant des violations d’additifs de couleur peuvent également être détenus dans les ports d’entrée américains.
Étiquetage des produits approuvés par la FDA
Les fabricants de médicaments et de dispositifs qui nécessitent l’approbation de la FDA peuvent inclure l’expression « Approuvé par la FDA » sur l’étiquetage du produit. Cela est valable tant que le fabricant a reçu une lettre de la FDA confirmant son approbation.
Vous ne devez jamais utiliser le logo FDA sur l’étiquetage d’un produit, même s’il a été approuvé. Cela pourrait impliquer que le produit est approuvé par la FDA, par conséquent, une utilisation non autorisée du logo peut enfreindre la loi fédérale. Les fabricants qui utilisent le logo de la FDA sur l’étiquetage de leur produit peuvent être soumis à une responsabilité civile ou pénale.
Mis à part l’approbation, les établissements alimentaires, les établissements pharmaceutiques, les établissements de dispositifs et les sociétés cosmétiques doivent toujours se conformer aux bonnes pratiques de fabrication actuelles (BPF) de la FDA et aux exigences d’étiquetage. Pour les produits qui nécessitent une approbation, tels que certains médicaments et dispositifs, l’étiquetage est approuvé lorsque le produit est approuvé. Cependant, les étiquettes ne sont généralement pas soumises à l’approbation de la FDA.
Vous vous demandez peut-être comment la FDA applique ses exigences lorsque tant de produits ne nécessitent pas d’approbation préalable à la mise sur le marché. La FDA réglemente les produits en effectuant des inspections de routine des installations et des inspections des expéditions randomisées à la frontière des États-Unis.
Travailler vers l’approbation de la FDA avec Registrar Corp
Registrar Corp aide les entreprises agroalimentaires, pharmaceutiques, de dispositifs médicaux et cosmétiques à se conformer aux réglementations de la FDA américaine.
Nous pouvons travailler avec vous pour enregistrer votre entreprise auprès de la FDA, répertorier vos produits auprès de la FDA et examiner les étiquettes des produits pour la conformité à la FDA. Notre équipe de spécialistes de la réglementation peut également aider à soumettre des additifs de couleur à la FDA pour la certification des lots de couleurs.
Vous avez encore des questions sur l’approbation de la FDA ou vous souhaitez en savoir plus sur Registrar Corp ?
Appelez le +1-757-224-0177 ou discutez avec un conseiller réglementaire 24 heures sur 24.



