Imparare a ottenere l’approvazione della FDA, o se ne hai bisogno, dipende dal tipo di prodotto che stai commercializzando negli Stati Uniti. La FDA non richiede l’approvazione di tutti i tipi di prodotti. In alcuni casi, solo alcuni ingredienti devono essere approvati.
Continua a leggere per scoprire quali settori e prodotti regolamentati richiedono l’approvazione della FDA e come ottenerli quando necessario.
Approvazione FDA di alimenti, bevande e integratori alimentari
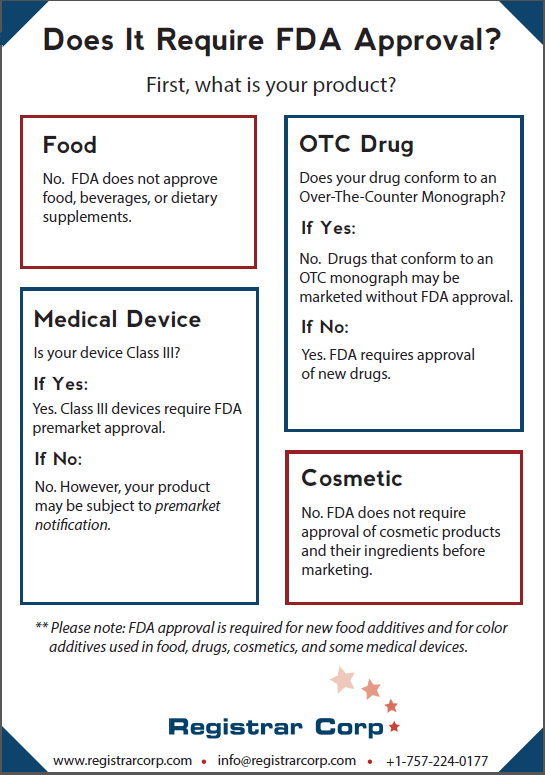
La FDA non approva alimenti, bevande o integratori alimentari. Gli stabilimenti alimentari non necessitano di alcun tipo di certificazione o approvazione prima di distribuire i prodotti negli Stati Uniti.
La maggior parte delle strutture alimentari deve registrarsi presso la FDA e rimanere conforme alla legge di modernizzazione della sicurezza alimentare (FSMA), ma la registrazione e la conformità non indicano che la struttura o i suoi prodotti sono approvati dalla FDA. La registrazione degli stabilimenti alimentari della FDA ha due scopi principali:
Innanzitutto, fornisce all’agenzia le informazioni di contatto necessarie per le comunicazioni di routine e di emergenza. In secondo luogo, informa la FDA sui prodotti e le attività di una struttura. Ciò consente alla FDA di impostare un programma di ispezione basato sui potenziali rischi per la sicurezza alimentare.
Una delle poche eccezioni all’approvazione della FDA per alimenti, bevande e integratori alimentari è rappresentata dagli additivi alimentari. I nuovi additivi alimentari richiedono l’approvazione della FDA. Se un produttore desidera utilizzare un nuovo additivo alimentare nel proprio prodotto, dovrà sottoporre l’additivo a test appropriati e dimostrarne la sicurezza alla FDA.
Un’altra potenziale eccezione sono gli integratori alimentari che sostengono di trattare, diagnosticare, prevenire o curare le malattie. Se un’azienda commercializza un integratore alimentare in base a una qualsiasi di queste affermazioni, potrebbe essere soggetto alle normative sui farmaci e potrebbe richiedere l’approvazione della FDA se non soddisfa determinati requisiti (vedere Approvazione FDA dei prodotti farmaceutici).
Approvazione FDA dei prodotti farmaceutici
Se un nuovo prodotto farmaceutico richiede o meno l’approvazione della FDA dipende dal fatto che il nuovo farmaco sia conforme a una monografia da banco (OTC). Le monografie OTC stabiliscono le condizioni in base alle quali la FDA ha predeterminato che un farmaco sarà sicuro ed efficace.
Una volta che una monografia da banco è definitiva, le aziende farmaceutiche possono commercializzare farmaci da banco conformi alla monografia senza essere approvati dalla FDA. L’FDA utilizza anche la discrezione esecutiva per consentire l’immissione in commercio di alcuni farmaci senza approvazione se sono conformi alle monografie finali provvisorie.
Tuttavia, se un nuovo farmaco non è conforme a una monografia, sarà necessaria l’approvazione della FDA. Per ottenere l’approvazione della FDA, i produttori di farmaci devono condurre test clinici di laboratorio, sugli animali e sugli esseri umani e inviare i propri dati alla FDA.
La FDA esaminerà quindi i dati e potrà approvare il farmaco se l’agenzia stabilisce che i benefici del farmaco superano i rischi per l’uso previsto. La commercializzazione di un nuovo farmaco che non è conforme a una monografia OTC senza l’approvazione della FDA è considerata la commercializzazione di un nuovo farmaco non approvato, che è un atto vietato ai sensi del Food, Drug, and Cosmetic Act (FD&C Act).
Sebbene la FDA approvi nuovi farmaci, l’agenzia non approva i farmaci composti. Le aziende farmaceutiche devono registrarsi presso la FDA ed elencare i propri prodotti, ma né la registrazione né l’elenco indicano l’approvazione della FDA della struttura o dei suoi prodotti.
Approvazione FDA dei dispositivi medici
La FDA colloca i dispositivi medici in una delle tre categorie basate sul rischio: Classe I, Classe II e Classe III. I dispositivi di classe III sono i dispositivi a più alto rischio e gli unici che richiedono l’approvazione della FDA prima dell’immissione in commercio. I produttori di dispositivi di Classe III devono dimostrare alla FDA che il dispositivo fornisce una ragionevole garanzia di sicurezza ed efficacia.
I dispositivi di classe I e II non richiedono l’approvazione della FDA. Questi dispositivi, a meno che non siano esenti ai sensi dell’FD&C Act, devono invece inviare una notifica pre-commercializzazione (510(k)) alla FDA. Lo scopo di un 510(k) è dimostrare alla FDA che il dispositivo è sostanzialmente equivalente (come sicuro ed efficace) a un dispositivo già commercializzato legalmente. Se la FDA stabilisce che il dispositivo è sostanzialmente equivalente a un dispositivo legalmente commercializzato, l’agenzia cancella il prodotto per la commercializzazione piuttosto che approvarlo.
Gli stabilimenti di dispositivi devono registrare ed elencare i propri dispositivi presso la FDA. Tuttavia, come per alimenti, bevande, integratori alimentari e prodotti farmaceutici, né la registrazione né l’elenco indicano l’approvazione dell’FDA della struttura o dei suoi dispositivi
Approvazione FDA dei cosmetici
La FDA non richiede che i prodotti cosmetici o i loro ingredienti siano approvati prima di essere immessi sul mercato. L’unica eccezione è rappresentata dagli additivi colorati (vedere l’Approvazione FDA degli additivi colorati).
Prima del 2022, le aziende cosmetiche non dovevano registrarsi presso la FDA. Avevano solo bisogno che i loro prodotti fossero considerati sicuri per l’uso previsto. Tuttavia, da quando il recente Modernization of Cosmetic Regulations Act (MoCRA) è stato approvato il 29 dicembre 2022, la FDA ora ha una maggiore supervisione sul settore cosmetico. Nell’ambito di questa nuova supervisione, le aziende cosmetiche devono ora registrarsi presso la FDA.
Anche in questo caso, la registrazione presso la FDA non equivale all’approvazione. La registrazione FDA di una struttura cosmetica fornisce solo informazioni sulla struttura e sui prodotti che commercializza negli Stati Uniti.
Analogamente agli integratori alimentari, esiste una potenziale eccezione per l’approvazione dei prodotti cosmetici da parte della FDA. Alcune affermazioni fatte nell’etichettatura cosmetica possono indurre la FDA a regolare un prodotto cosmetico come farmaco. E in alcuni casi, ciò potrebbe far sì che il prodotto richieda l’approvazione della FDA (vedere Approvazione FDA dei prodotti farmaceutici).
Approvazione FDA degli additivi colore
È necessaria l’approvazione per gli additivi di colore utilizzati in alimenti, farmaci, cosmetici e alcuni dispositivi medici. Alcuni colori ad alto rischio richiedono anche la certificazione dei lotti di colore FDA per ogni singolo lotto. Gli additivi colorati possono essere utilizzati solo in conformità con gli usi, le specifiche e le restrizioni approvati.
I prodotti che contengono additivi di colore non approvati sono considerati adulterati ai sensi dell’FD&C Act. I prodotti adulterati non possono essere distribuiti nel commercio interstatale negli Stati Uniti. I prodotti cosmetici con violazioni di additivi cromatici possono essere trattenuti anche nei porti di ingresso degli Stati Uniti.
Etichettatura dei prodotti approvati dalla FDA
I produttori di farmaci e dispositivi che richiedono l’approvazione della FDA possono includere la frase “Approvata dalla FDA” sull’etichettatura del prodotto. Questo fino a quando il produttore ha ricevuto una lettera dalla FDA che ne conferma l’approvazione.
Non utilizzare mai il logo FDA sull’etichettatura di un prodotto, anche se è stato approvato. Ciò potrebbe implicare che il prodotto è approvato dalla FDA, pertanto l’uso non autorizzato del logo può violare la legge federale. I produttori che utilizzano il logo della FDA sull’etichettatura del prodotto possono essere soggetti a responsabilità civile o penale.
A parte l’approvazione, le strutture alimentari, le strutture farmaceutiche, le strutture di dispositivi e le aziende cosmetiche devono ancora rispettare le attuali buone pratiche di fabbricazione (CGMP) della FDA e i requisiti di etichettatura. Per i prodotti che richiedono l’approvazione, come alcuni farmaci e dispositivi, l’etichettatura è approvata quando il prodotto è approvato. Tuttavia, le etichette non sono generalmente soggette all’approvazione della FDA.
Forse ti stai chiedendo come la FDA applica i suoi requisiti quando così tanti prodotti non richiedono l’approvazione prima dell’immissione in commercio. La FDA regola i prodotti conducendo ispezioni di routine della struttura e ispezioni randomizzate delle spedizioni al confine con gli Stati Uniti.
Lavorare verso l’approvazione FDA con Registrar Corp
Registrar Corp aiuta le aziende di alimenti e bevande, farmaci, dispositivi medici e cosmetici a rispettare le normative FDA degli Stati Uniti.
Possiamo collaborare con voi per registrare la vostra azienda presso la FDA, elencare i vostri prodotti presso la FDA ed esaminare le etichette dei prodotti per verificarne la conformità alla FDA. Il nostro team di specialisti normativi può anche aiutare a inviare additivi per il colore alla FDA per la certificazione dei lotti di colore.
Hai ancora domande sull’approvazione della FDA o vuoi saperne di più su Registrar Corp?
Chiamare il numero +1-757-224-0177 o chattare con un consulente normativo 24 ore su 24.



