Les consommateurs américains recherchent souvent des dates d’expiration lorsqu’ils décident si un produit peut être consommé ou utilisé en toute sécurité. Les dates apparaissent sur de nombreux produits, mais la Food and Drug Administration (FDA) des États-Unis ne réglemente pas la plupart de ces dates, leur signification est donc basée sur l’interprétation du fabricant. Les produits qui ne nécessitent pas de dates peuvent inclure des dates qui indiquent quand le fabricant pense que la qualité va diminuer, et n’indiquent pas nécessairement qu’un produit est dangereux après cette date.
Cependant, la FDA réglemente les dates de péremption de certains produits de manière plus stricte. Même dans le même secteur, les exigences de date peuvent varier en fonction du produit. Ces exigences de date d’expiration de la FDA peuvent inclure le respect d’un format particulier.
Obtenez de l’aide pour vous conformer à la FDA.
Les spécialistes de la réglementation de Registrar Corp peuvent vous aider à vérifier la conformité de votre produit à la FDA.
Si vous importez des produits réglementés aux États-Unis, suivre la formation FSVP peut vous aider à mieux comprendre les exigences de la FDA et à éviter les problèmes de conformité liés à l’étiquetage et à la date d’expiration.
Pour plus d’informations, appelez-nous au +1-757-224-0177, envoyez-nous un e-mail à info@registrarcorp.com, ou discutez avec un conseiller réglementaire 24 heures sur 24 sur www.registrarcorp.com/livechat.
Votre produit a-t-il besoin d’une date d’expiration ? Poursuivez votre lecture pour en savoir plus sur les exigences relatives aux étiquettes de date de péremption pour certains produits réglementés par la FDA.
Nourriture
La FDA n’exige généralement pas des fabricants qu’ils indiquent une date de péremption sur l’étiquette d’un produit alimentaire. Les entreprises peuvent choisir d’inclure volontairement une date d’expiration sur une étiquette si elles souhaitent informer les consommateurs du délai dans lequel un produit peut être censé maintenir la qualité et la saveur.
Si un fabricant choisit d’appliquer une étiquette de date, l’étiquette ne peut pas inclure d’informations fausses ou trompeuses. La date n’a pas besoin d’être approuvée, car il s’agit d’une estimation de la qualité, et les entreprises n’ont pas besoin de fournir de justification pour la manière dont elles ont choisi la date.
La loi fédérale n’exige pas de dates d’expiration pour la plupart des aliments, bien que les réglementations au niveau de l’État puissent exiger des dates pour certains aliments.
Cependant, la FDA exige que les étiquettes de lait maternisé contiennent une date de péremption. Les fabricants doivent inclure une date de péremption sur le lait maternisé et confirmer la date pour indiquer avec précision la durée pendant laquelle le produit sera d’une qualité acceptable, en conservant au moins une quantité minimale de tous les nutriments énumérés.
Cependant, dans les établissements fabriquant des préparations pour nourrissons, un PCQI formé peut jouer un rôle pour garantir que la stabilité des nutriments et la validation de leur durée de conservation sont conformes au plan de sécurité alimentaire, en particulier si la dégradation des nutriments pourrait avoir un impact sur la sécurité des produits ou la conformité réglementaire.
Suppléments
La FDA n’exige pas que les étiquettes des compléments alimentaires incluent une date de péremption, mais les fabricants peuvent en inclure une à condition que les informations ne soient pas trompeuses.
Cosmétiques
Actuellement, la loi fédérale n’exige pas des fabricants de cosmétiques qu’ils impriment les dates d’expiration sur les étiquettes des produits cosmétiques. Les fabricants incluront souvent un symbole « période après ouverture » (PAO) sur l’emballage pour indiquer combien de temps un consommateur doit utiliser le produit, mais cela est volontaire.
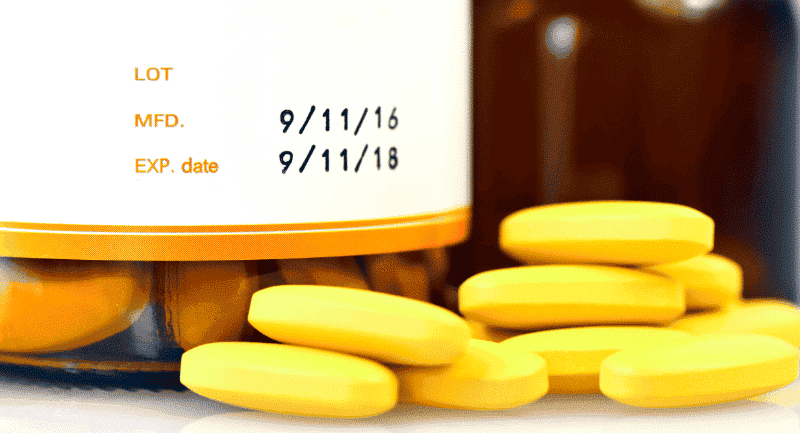
Produits pharmaceutiques
La FDA exige que les médicaments portent une étiquette indiquant une date de péremption sur l’emballage intérieur et extérieur. La date doit indiquer la « période pendant laquelle le produit est connu pour rester stable, ce qui signifie qu’il conserve sa résistance, sa qualité et sa pureté lorsqu’il est conservé conformément à ses conditions de stockage indiquées sur l’étiquette ». Certains médicaments sont exemptés ; les médicaments homéopathiques et ceux sans limitation de posologie stables pendant au moins trois ans ne sont pas tenus de porter une date de péremption.
Les fabricants de médicaments doivent déterminer la date de péremption d’un médicament par le biais de données de test de stabilité qui démontrent que le produit répond aux normes applicables de force, de qualité et de pureté pendant la période de temps proposée et conformément aux conditions de conservation proposées.
Dispositifs médicaux
En général, la FDA n’exige pas que la plupart des dispositifs médicaux portent une étiquette indiquant une date de péremption. Si un certain composant d’un dispositif n’est pas utile après une certaine date, la FDA peut exiger que l’étiquette indique cette date.
Les dispositifs de diagnostic in vitro stériles et non stériles doivent inclure une date de péremption ou toute autre indication de la qualité du dispositif au moment de l’utilisation.
Si l’étiquette d’un dispositif comporte une date de péremption, le fabricant doit effectuer des tests de stabilité pour déterminer la période pendant laquelle le dispositif est adapté à son utilisation prévue lorsqu’il est conservé conformément aux instructions de l’étiquette. La date de péremption, la date de fabrication ou toute autre date pour attirer l’attention de l’utilisateur doit inclure l’année, la date et le mois au format suivant : aaaa-mm-jj. Par exemple, le 6 février 2019 doit apparaître sur l’étiquette comme 2019-02-06. Un dispositif peut être exempté de cette réglementation de formatage s’il s’agit d’un produit combiné qui porte correctement un numéro NDC (National Drug Code) ou d’un produit électronique pour Radiological Health (qui est soumis aux réglementations de formatage de la date de fabrication pour les dispositifs médicaux électroniques).
Obtenez de l’aide pour les exigences de date d’expiration de la FDA et plus encore.
Les spécialistes de la réglementation de Registrar Corp peuvent vous aider à vérifier la conformité de votre produit à la FDA.
Pour plus d’informations, appelez-nous au +1-757-224-0177, envoyez-nous un e-mail à info@registrarcorp.com, ou discutez avec un conseiller réglementaire 24 heures sur 24 sur www.registrarcorp.com/livechat.