Preciso de aprovação da FDA? Obtenha conformidade com a FDA com a Registrar Corp
Aprender como obter a aprovação da FDA, ou determinar se você precisa dela, depende inteiramente do tipo de produto que você planeja comercializar nos EUA. Muitos presumem que todos os produtos devem ser revisados e aprovados antes de entrar no mercado, mas a realidade é muito mais sutil. A FDA não exige que todos os produtos sejam aprovados antes de entrar no mercado e, em alguns casos, apenas alguns componentes, como ingredientes específicos, devem passar pelo processo. O mal-entendido dessas distinções pode levar a atrasos dispendiosos, violações de rotulagem e até mesmo ações de execução.
Para tomar decisões informadas, as empresas precisam de mais do que definições: elas precisam entender os caminhos regulatórios, os riscos da não conformidade e as consequências de agir em mitos. Este guia analisa cada uma das principais categorias de produtos regulamentadas pela FDA, explicando quando a aprovação é necessária, quando não é e quais etapas de conformidade ainda se aplicam. Ele também aborda equívocos comuns, fornece um gráfico de referência rápida e links para recursos autorizados da FDA. Ao longo de todo o processo, uma verdade central é: O registro na FDA não é o mesmo que a aprovação da FDA, e presumir o contrário pode ser um erro caro.
Referência rápida: Requisitos de aprovação e registro da FDA
| Categoria | É necessária aprovação da FDA? | Registro necessário? | Principais exceções |
| Alimentos e bebidas | Não | Sim (a maioria das instalações) | Novos aditivos alimentares |
| Suplementos alimentares | Não | Sim (a maioria das instalações) | Alegações de doenças desencadeiam regulamentações de medicamentos |
| Medicamentos | Às vezes | Sim | As monografias de OTC em conformidade não exigem aprovação |
| Dispositivos médicos | Somente Classe III | Sim | Certas Classes I e II exigem liberação 510(k) |
| Cosméticos | Não (exceto aditivos coloridos) | Sim (em MoCRA) | Alegações que afetam a estrutura/função podem desencadear regulamentações de medicamentos |
| Aditivos de cor | Sim | N/A | Alguns exigem certificação em lote |
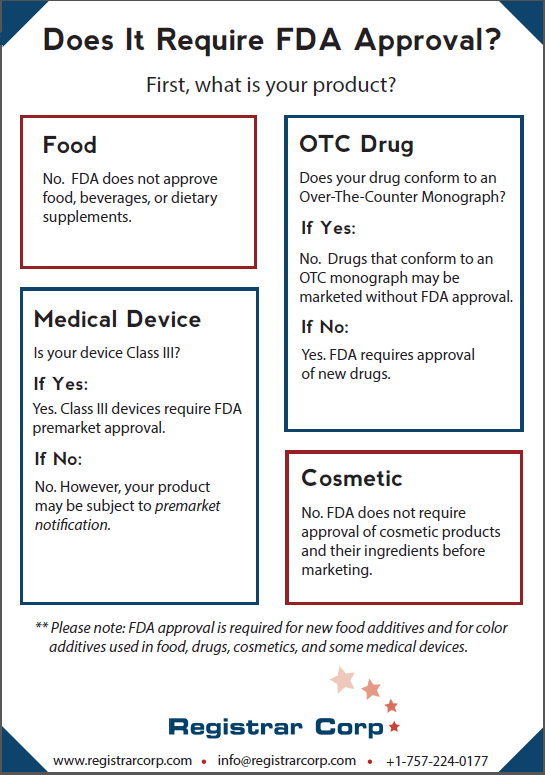
Aprovação da FDA de alimentos, bebidas e suplementos alimentares
Ao contrário da crença popular, a FDA não aprova alimentos, bebidas ou suplementos alimentares antes de serem vendidos nos Estados Unidos. As instalações de alimentos não precisam de certificação ou aprovação pré-comercialização, mas a maioria deve se registrar na FDA e cumprir a Lei de Modernização da Segurança Alimentar (FSMA).
O registro tem duas finalidades principais: fornece à FDA as informações de contato necessárias para comunicações de rotina e de emergência, e informa a agência sobre os produtos e atividades na instalação. Essas informações permitem que a FDA defina prioridades de inspeção com base em possíveis riscos de segurança de alimentos, concentrando a atenção em operações de alto risco enquanto ainda realiza verificações randomizadas. Por exemplo, uma instalação que produz alimentos prontos para consumo pode ser inspecionada com mais frequência do que um processador de commodities de baixo risco.
A FDA aplica esses requisitos inspecionando instalações registradas, emitindo cartas de advertência para violações e detendo remessas que pareçam não estar em conformidade. O registro também permite o alcance direcionado durante recalls ou emergências de saúde pública. No entanto, embora o registro seja necessário para a maioria das instalações de alimentos e suplementos, ele não deve ser confundido com a aprovação do produto. Essa distinção é fundamental em todos os setores regulamentados pela FDA.
Além disso, a FSMA exige que as instalações implementem e mantenham um plano de segurança de alimentos supervisionado por um indivíduo qualificado para controles preventivos (Preventive Controls Qualified Individual, PCQI). Concluir um programa de treinamento de PCQI reconhecido ajuda a garantir que a pessoa responsável esteja equipada para identificar perigos, validar controles e gerenciar a conformidade. Sem um PCQI designado, as empresas correm o risco de ações de execução e atrasos na resolução dos resultados da inspeção.
Uma das poucas exceções nesta categoria são os aditivos alimentares. A menos que seja geralmente reconhecido como seguro (GRAS), qualquer novo aditivo deve ser aprovado por meio de uma petição de aditivo alimentar, que exige testes rigorosos e dados de segurança de acordo com a Lei FD&C.
O uso pretendido é importante: quando um produto cruza a linha da nutrição para as alegações terapêuticas, ele pode entrar em uma nova categoria regulatória, que exige aprovação. Por exemplo, suplementos alimentares que alegam tratar, diagnosticar, prevenir ou curar doenças podem ser regulamentados como medicamentos e, em seguida, estariam sujeitos ao processo de aprovação descrito na próxima seção.
Destruindo o mito: Alimentos “aprovados pela FDA” não existem. Mesmo que uma instalação esteja registrada e totalmente em conformidade, nem a instalação nem seus produtos foram oficialmente aprovados, a menos que ingredientes específicos, como aditivos, tenham passado pelo processo de aprovação.
Aprovação da FDA de produtos medicamentosos: Entendendo como obter aprovação da FDA
Se um novo medicamento requer aprovação da FDA depende de estar em conformidade com uma monografia de venda livre (over-the-counter, OTC). As monografias OTC detalham condições específicas sob as quais um medicamento é considerado seguro e eficaz sem aprovação pré-comercialização. As monografias finais funcionam como “receitas” para categorias de medicamentos, especificando ingredientes, dosagens, rotulagem e padrões de teste. A FDA também exerce o critério de aplicação para certos medicamentos sob monografias finais provisórias.
Se um medicamento não estiver em conformidade com uma monografia de OTC, ele deve passar por aprovação pré-comercialização. Esse processo envolve análise laboratorial, estudos em animais e estudos clínicos em humanos em fases, seguidos pelo envio de dados à FDA. A agência analisa os dados para determinar se os benefícios superam os riscos para o uso pretendido. A comercialização de um medicamento não conforme sem aprovação é proibida de acordo com a Lei de Alimentos, Medicamentos e Cosméticos (FD&C Act). A FDA não aprova medicamentos compostos.
Os estabelecimentos de medicamentos devem registrar e listar seus produtos com a FDA para supervisionar a agência quanto à inspeção e ao monitoramento de conformidade. Novamente, este processo de registro e listagem, embora necessário, não implica que a FDA tenha aprovado o medicamento ou o estabelecimento.
Assim como os medicamentos, os dispositivos médicos seguem um caminho em níveis para o mercado, embora os critérios e os limites de aprovação sejam diferentes.
Destruindo o mito: Muitos acreditam que a FDA deve aprovar todos os medicamentos antes de serem comercializados. Na realidade, se um medicamento estiver em conformidade com uma monografia de OTC, ele pode ser comercializado legalmente sem aprovação pré-comercialização.
Aprovação da FDA de dispositivos médicos: Como obter aprovação da FDA para produtos de Classe III
A FDA classifica os dispositivos médicos em três categorias com base no risco: Classe I (baixo risco), Classe II (risco moderado) e Classe III (alto risco). Dispositivos de classe III, como marca-passos ou certos implantes, exigem aprovação pré-comercialização, que exige evidências robustas de segurança e eficácia por meio de estudos clínicos e documentação técnica.
Dispositivos de Classe I e II, a menos que isentos, devem enviar uma notificação pré-comercialização (510(k)) demonstrando equivalência substancial a um dispositivo legalmente comercializado. Isso envolve fornecer especificações detalhadas do produto, dados de desempenho e, às vezes, evidências clínicas. Se a FDA determinar equivalência, ela “libera” o dispositivo para comercialização em vez de “aprovar”. Assim como ocorre com outras categorias, os requisitos de registro e listagem de dispositivos ajudam a FDA a monitorar a atividade do setor, mas não equivalem à aprovação do produto.
Destruindo o mito: “Aprovado pela FDA” e “aprovado pela FDA” não são intercambiáveis. Daqueles sujeitos à análise da FDA, a maioria dos dispositivos é liberada através do processo 510(k), não aprovado. Apenas dispositivos de Classe III exigem aprovação pré-comercialização completa.
Aprovação de cosméticos pela FDA
A FDA não exige que produtos cosméticos ou seus ingredientes sejam aprovados antes de irem ao mercado, exceto aditivos de cor. Antes de dezembro de 2022, as empresas de cosméticos não precisavam se registrar na FDA. De acordo com a Lei de Modernização de Regulamentos Cosméticos (MoCRA), as empresas agora devem registrar suas instalações e listar seus produtos.
Antes do MoCRA, a supervisão da FDA dependia muito da aplicação pós-comercialização, intervindo quando os produtos eram considerados inseguros ou com a marca errada. Agora, com o registro obrigatório, a FDA tem melhor visibilidade, pode avaliar a conformidade proativamente e agendar inspeções com base nos perfis de risco.
É importante observar que o registro não é o mesmo que aprovação. O equívoco persiste de que o registro da FDA indica endosso de um produto, quando na verdade ele simplesmente concede à FDA a autoridade para inspecionar e monitorar a conformidade. Além disso, alegações cosméticas que implicam benefícios terapêuticos, como curar ou prevenir doenças, podem fazer com que a FDA regule o produto como um medicamento, o que pode exigir aprovação.
Destruindo o mito: O registro cosmético sob o MoCRA não significa que a FDA aprovou o produto. A aprovação se aplica apenas a aditivos de cor específicos ou se o produto for regulado como um medicamento.
Uma exceção importante a esse modelo sem aprovação são os aditivos de cores, usados em cosméticos, alimentos ou medicamentos, que são regulamentados sob seu próprio processo de aprovação.
Aprovação da FDA de aditivos coloridos
A FDA deve aprovar aditivos de cores usados em alimentos, medicamentos, cosméticos e certos dispositivos médicos. Essa aprovação garante que o aditivo atenda aos padrões de segurança para o uso pretendido. Certas cores de alto risco exigem certificação de lote para cada lote antes do uso.
Os aditivos coloridos só podem ser usados de acordo com as especificações e restrições aprovadas. Produtos contendo aditivos coloridos não aprovados são considerados adulterados de acordo com a Lei FD&C e podem ser detidos nos portos de entrada dos EUA.
Destruindo o mito: A aprovação de um aditivo de cor para um uso não permite que ele seja usado em outras categorias de produtos. Cada uso aprovado tem limitações e condições específicas.
Rotulagem de produtos aprovados pela FDA
Mesmo para produtos aprovados, há outra área que ultrapassa os fabricantes: rotulagem. Os fabricantes de medicamentos e dispositivos que exigem aprovação podem incluir “Aprovado pela FDA” na rotulagem do produto se tiverem recebido confirmação por escrito da agência. O logotipo da FDA, no entanto, não pode ser usado, pois implica endosso e pode levar a responsabilidade civil ou criminal. Independentemente do status de aprovação, todas as instalações regulamentadas devem cumprir as Boas Práticas de Fabricação Atuais (CGMPs) e os requisitos de rotulagem.
Para produtos que exigem aprovação ou liberação, como certos medicamentos e dispositivos, a FDA também analisa e aprova a rotulagem do produto como parte do processo. No entanto, na maioria dos outros casos, os rótulos não são pré-aprovados pela FDA.
A FDA impõe a conformidade por meio de inspeções de instalações, amostragem de produtos e verificações de envio na fronteira.
Trabalhar para obter aprovação da FDA com a Registrar Corp
A Registrar Corp ajuda empresas de alimentos, bebidas, medicamentos, dispositivos médicos e cosméticos a navegar pelas regulamentações da FDA dos EUA. Auxiliamos no registro de instalações, listagem de produtos, revisão de rótulos e certificação de lotes de aditivos de cores. Agir antes de um prazo de conformidade ou ação de execução pode evitar atrasos dispendiosos e perda de acesso ao mercado.
Para assistência imediata e para garantir que você atenda a todos os requisitos aplicáveis, ligue para +1-757-224-0177 ou converse com um consultor regulatório 24 horas por dia, 7 dias por semana.



