Afin de respecter la date limite du 29 décembre 2023, les sociétés de cosmétiques se préparent à se conformer aux nouvelles exigences de la loi sur la modernisation de la réglementation des cosmétiques (MoCRA).
La FDA continue de partager des conseils sur le nouveau portail de soumission électronique, le format Cosmetics Direct et l’étiquetage structuré des produits (SPL).
Portail direct des cosmétiques
En septembre 2023, la FDA a publié un nouveau document de 81 pages, Electronic Submission Portal Screenshots for Cosmetics . Ce document fournit le parcours de l’utilisateur pour l’enregistrement de l’établissement et la liste des produits cosmétiques, comme requis par le MoCRA.
Il affiche également les échecs de validation qui peuvent se produire lors de la soumission de vos informations.
La FDA a fait un travail fantastique pour éduquer le secteur sur ce qu’il faut attendre du MoCRA. Cet aperçu aide les entreprises à déterminer si elles sont capables de gérer les soumissions sur le portail ou si elles auront besoin d’une expertise externe.
La FDA a commencé à accepter les commentaires sur le nouveau projet de portail de soumission électronique (Cosmetics Direct) et les formulaires papier. La date limite pour soumettre un commentaire était le 18 octobre 2023.
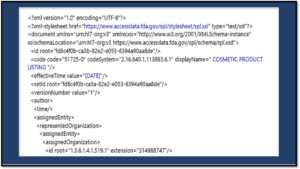
Un aperçu du format SPL (Structured Product Labeling)
Le nouveau portail Cosmetics Direct met en évidence le format SPL, un composant clé du logiciel d’étiquetage structuré des produits, qui sera requis pour toutes les soumissions cosmétiques. Pour les sociétés cosmétiques où le format SPL est un nouveau territoire, les exemples, le formatage XML et la validation peuvent sembler compliqués.
Avant que les captures d’écran ne soient publiées, les seules informations disponibles pour le secteur étaient dans l’ébauche de directives pour le secteur. Ces directives indiquaient que vous deviez soumettre les données d’inscription et de liste au format SPL et donnaient les détails suivants :
« L’enregistrement des établissements de produits cosmétiques et la liste des produits seront disponibles en utilisant le même processus de soumission électronique disponible pour enregistrer un établissement et répertorier un médicament auprès de la FDA. Cela permettra de rationaliser le processus de soumission des informations d’enregistrement et de référencement pour les établissements et produits cosmétiques pour les entités qui soumettent également des informations sur l’établissement et la référencement des médicaments. »
Guide de mise en œuvre SPL et procédures de validation
En octobre, la FDA a publié une directive pour la mise en œuvre et la validation de la SPL. Le guide de 275 pages décrit Cosmetics Direct comme un outil de création SPL convivial qui effectuera les validations initiales, créera et enregistrera les soumissions SPL et les soumettra à la FDA.
Le 14 novembre, la FDA a mis à jour le Guide de mise en œuvre de la SPL pour inclure des mises à jour supplémentaires des enregistrements des installations de produits cosmétiques et des listes de produits incluses dans le cadre de la SPL.
Prochaines échéances de conformité au MoCRA
La FDA n’a pas encore annoncé la date exacte de lancement du portail de soumission Cosmetics Direct. Mais il sera lancé à temps pour que les installations respectent la prochaine échéance du 29 décembre 2023.
La FDA a annoncé une date d’application différée du 1er juillet 2024, soit six mois après la date limite du 29 décembre. Cette mise à jour reconnaît la complexité des soumissions SPL et donne aux établissements de cosmétiques plus de temps pour se conformer aux exigences.
L’extension s’applique aux installations cosmétiques qui ont commencé à fabriquer ou à traiter des produits cosmétiques après le 29 décembre 2022. Au lieu de devoir s’inscrire avant la date limite de décembre, ils devront simplement terminer leur inscription avant le 1er juillet.
Les entreprises qui ont commencé à commercialiser des produits cosmétiques après le 29 décembre 2022 disposeront également de six mois supplémentaires avant que la FDA n’applique les exigences de cotation du MoCRA.
Registrar Corp peut vous aider
Grâce à la vaste expérience de Registrar Corp dans la soumission des listes de médicaments de la FDA au format SPL, les sociétés de cosmétiques font confiance à Registrar Corp pour s’assurer qu’elles respectent les nouvelles exigences de la FDA en matière de cosmétiques en vertu du MoCRA et les assister dans les soumissions de Cosmetics Direct.
Consultez l’intégralité du document prévisualisant le nouveau portail des cosmétiques et découvrez ce que Registrar Corp peut faire pour que votre entreprise se conforme aux nouvelles réglementations.


