Benötige ich eine FDA-Zulassung? Erreichen der FDA-Compliance mit Registrar Corp
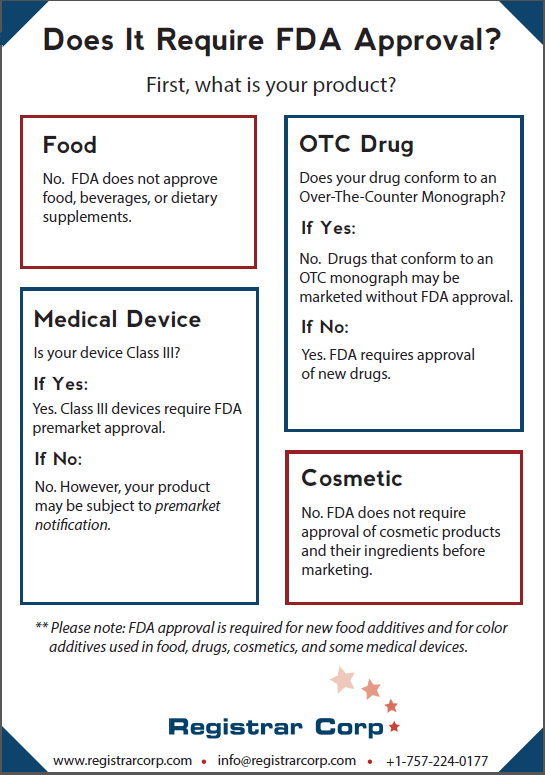
Das Erlernen der FDA-Zulassung – oder die Bestimmung, ob Sie sie überhaupt benötigen – hängt vollständig von der Art des Produkts ab, das Sie in den USA vermarkten möchten. Viele gehen davon aus, dass alle Produkte vor dem Markteintritt überprüft und genehmigt werden müssen, aber die Realität ist weitaus differenzierter. Die FDA verlangt nicht, dass alle Produkte vor dem Inverkehrbringen zugelassen werden, und in einigen Fällen müssen nur bestimmte Komponenten, wie bestimmte Inhaltsstoffe, den Prozess durchlaufen. Ein Missverständnis dieser Unterschiede kann zu kostspieligen Verzögerungen, Kennzeichnungsverletzungen und sogar Durchsetzungsmaßnahmen führen.
Um fundierte Entscheidungen zu treffen, benötigen Unternehmen mehr als nur Definitionen – sie müssen die regulatorischen Pfade, die Risiken der Nichteinhaltung und die Folgen von Mythen verstehen. Dieser Leitfaden führt durch jede wichtige Produktkategorie, die von der FDA reguliert wird, und erklärt, wann eine Genehmigung erforderlich ist, wann nicht und welche Compliance-Schritte weiterhin gelten. Es behandelt auch häufige Missverständnisse, bietet eine Schnellreferenztabelle und Links zu maßgeblichen FDA-Ressourcen. Eine Kernwahrheit ist: Die FDA-Zulassung ist nicht die gleiche wie die FDA-Zulassung, und unter der Annahme, dass etwas anderes ein kostspieliger Fehler sein kann.
Kurzreferenz: FDA-Zulassungs- und Registrierungsanforderungen
| Kategorie | FDA-Zulassung erforderlich? | Registrierung erforderlich? | Wichtige Ausnahmen |
| Lebensmittel und Getränke | Nein | Ja (die meisten Einrichtungen) | Neue Lebensmittelzusätze |
| Nahrungsergänzungsmittel | Nein | Ja (die meisten Einrichtungen) | Krankheitsansprüche lösen Arzneimittelvorschriften aus |
| Medikamente | Manchmal | Ja | Die Einhaltung von OTC-Monographien erfordert keine Genehmigung |
| Medizinische Geräte | Nur Klasse III | Ja | Bestimmte Klassen I und II erfordern einen Abstand von 510(k) |
| Kosmetika | Nein (außer Farbzusätze) | Ja (unter MoCRA) | Behauptungen, die Struktur/Funktion zu beeinflussen, können Arzneimittelvorschriften auslösen |
| Farbzusatzstoffe | Ja | Nicht zutreffend | Einige erfordern eine Chargenzertifizierung |
FDA-Zulassung von Lebensmitteln, Getränken und Nahrungsergänzungsmitteln
Entgegen der weit verbreiteten Meinung genehmigt die FDA keine Lebensmittel, Getränke oder Nahrungsergänzungsmittel, bevor sie in den Vereinigten Staaten verkauft werden. Lebensmitteleinrichtungen benötigen keine Zertifizierung oder Zulassung vor der Markteinführung, aber die meisten müssen sich bei der FDA registrieren und den Food Safety Modernization Act (FSMA) einhalten.
Die Registrierung dient zwei Hauptzwecken: Sie gibt der FDA die notwendigen Kontaktinformationen für die routinemäßige und Notfallkommunikation und informiert die Behörde über die Produkte und Aktivitäten in der Einrichtung. Diese Informationen ermöglichen es der FDA, Inspektionsprioritäten auf der Grundlage potenzieller Lebensmittelsicherheitsrisiken festzulegen, wobei die Aufmerksamkeit auf Vorgänge mit höherem Risiko gelenkt wird und gleichzeitig randomisierte Prüfungen durchgeführt werden. So kann beispielsweise eine Einrichtung, die essensfertige Lebensmittel herstellt, häufiger inspiziert werden als ein Rohstoffverarbeiter mit geringem Risiko.
Die FDA setzt diese Anforderungen durch, indem sie registrierte Einrichtungen inspiziert, Warnschreiben für Verstöße ausstellt und Sendungen festhält, die nicht konform erscheinen. Die Registrierung ermöglicht auch eine gezielte Kontaktaufnahme bei Rückrufen oder Notfällen im öffentlichen Gesundheitswesen. Obwohl die Registrierung für die meisten Lebensmittel- und Nahrungsergänzungsmitteleinrichtungen erforderlich ist, sollte sie nicht mit der Produktzulassung verwechselt werden. Diese Unterscheidung ist in allen von der FDA regulierten Branchen von entscheidender Bedeutung.
Darüber hinaus schreibt das FSMA vor, dass die Einrichtungen einen Lebensmittelsicherheitsplan implementieren und pflegen, der von einer qualifizierten Person für präventive Kontrollen (Preventive Controls Qualified Individual, PCQI) überwacht wird. Das Abschließen eines anerkannten PCQI-Schulungsprogramms hilft sicherzustellen, dass die verantwortliche Person in der Lage ist, Gefahren zu identifizieren, Kontrollen zu validieren und die Compliance zu verwalten. Ohne einen bestimmten PCQI riskieren Unternehmen Durchsetzungsmaßnahmen und Verzögerungen bei der Lösung von Inspektionsergebnissen.
Eine der wenigen Ausnahmen in dieser Kategorie sind Lebensmittelzusätze. Sofern es nicht allgemein als sicher (GRAS) anerkannt ist, muss jeder neue Zusatzstoff durch einen Antrag auf Lebensmittelzusatz genehmigt werden, der strenge Tests und Sicherheitsdaten gemäß dem FD&C Act erfordert.
Die bestimmungsgemäße Verwendung ist wichtig: Wenn ein Produkt die Grenze von der Ernährung bis hin zu therapeutischen Ansprüchen überschreitet, kann es in eine neue regulatorische Kategorie eintreten – eine, die eine Genehmigung erfordert. So können beispielsweise Nahrungsergänzungsmittel, die behaupten, Krankheiten zu behandeln, zu diagnostizieren, zu verhindern oder zu heilen, als Medikamente reguliert werden und unterliegen dann dem im nächsten Abschnitt beschriebenen Genehmigungsverfahren.
Den Mythos aufbrechen: „FDA-zugelassene“ Lebensmittel existieren nicht. Selbst wenn eine Einrichtung registriert und vollständig konform ist, wurden weder die Einrichtung noch ihre Produkte offiziell zugelassen, es sei denn, bestimmte Inhaltsstoffe, wie z. B. Additive, haben den Genehmigungsprozess durchlaufen.
FDA-Zulassung von Arzneimitteln: Verstehen, wie man die FDA-Zulassung erhält
Ob ein neues Medikament die FDA-Zulassung erfordert, hängt davon ab, ob es einer rezeptfreien (OTC) Monographie entspricht. OTC-Monographien beschreiben spezifische Bedingungen, unter denen ein Medikament ohne Zulassung vor der Markteinführung als sicher und wirksam erachtet wird. Endgültige Monographien dienen als „Rezepte“ für Medikamentenkategorien, die Inhaltsstoffe, Dosierungen, Kennzeichnungs- und Teststandards angeben. Die FDA übt für bestimmte Medikamente auch das Ermessen der Durchsetzung unter vorläufigen endgültigen Monographien aus.
Wenn ein Medikament nicht einer OTC-Monographie entspricht, muss es vor der Markteinführung zugelassen werden. Dieser Prozess umfasst Laboranalysen, Tierstudien und phasenweise klinische Studien am Menschen, gefolgt von der Einreichung von Daten bei der FDA. Die Behörde prüft die Daten, um festzustellen, ob der Nutzen die Risiken für den beabsichtigten Verwendungszweck überwiegt. Die Vermarktung eines nicht-konformen Medikaments ohne Genehmigung ist gemäß dem Food, Drug and Cosmetic Act (FD&C Act) verboten. Die FDA genehmigt keine zusammengesetzten Medikamente.
Arzneimittelbetriebe müssen ihre Produkte bei der FDA registrieren und auflisten, um der Behörde die Aufsicht über die Inspektion und die Compliance-Überwachung zu geben. Auch hier bedeutet dieser Registrierungs- und Listungsprozess, wenn erforderlich, nicht, dass die FDA das Medikament oder die Einrichtung zugelassen hat.
Ähnlich wie Medikamente folgen medizinische Geräte einem abgestuften Marktpfad – obwohl die Kriterien und Zulassungsschwellen unterschiedlich sind.
Den Mythos aufbrechen: Viele sind der Meinung, dass die FDA alle Medikamente genehmigen muss, bevor sie vermarktet werden. In Wirklichkeit kann ein Arzneimittel, das einer OTC-Monographie entspricht, ohne Zulassung vor dem Inverkehrbringen legal vermarktet werden.
FDA-Zulassung von Medizinprodukten: So erhalten Sie die FDA-Zulassung für Produkte der Klasse III
Die FDA klassifiziert Medizinprodukte auf der Grundlage des Risikos in drei Kategorien: Klasse I (niedriges Risiko), Klasse II (mittleres Risiko) und Klasse III (hohes Risiko). Geräte der Klasse III, wie z. B. Herzschrittmacher oder bestimmte Implantate, erfordern eine Zulassung vor der Markteinführung, die einen robusten Nachweis der Sicherheit und Wirksamkeit durch klinische Studien und technische Dokumentation erfordert.
Geräte der Klassen I und II müssen, sofern sie nicht ausgenommen sind, eine Benachrichtigung vor der Markteinführung (510(k)) einreichen, die eine wesentliche Gleichwertigkeit mit einem legal vermarkteten Gerät belegt. Dazu gehören detaillierte Produktspezifikationen, Leistungsdaten und manchmal klinische Nachweise. Wenn die FDA die Äquivalenz bestimmt, „löscht“ sie das Produkt für die Vermarktung, anstatt es zu „genehmigen“. Wie bei anderen Kategorien helfen die Anforderungen an die Registrierung und Auflistung von Geräten der FDA, die Branchenaktivitäten zu überwachen, entsprechen aber nicht der Produktzulassung.
Den Mythos aufbrechen: „FDA-zugelassen“ und „FDA-zugelassen“ sind nicht austauschbar. Von denjenigen, die einer FDA-Prüfung unterliegen, werden die meisten Geräte über den 510(k)-Prozess freigegeben, nicht genehmigt. Nur Produkte der Klasse III erfordern eine vollständige Zulassung vor der Markteinführung.
FDA-Zulassung von Kosmetika
Die FDA verlangt keine Zulassung von Kosmetikprodukten oder deren Inhaltsstoffen, bevor sie auf den Markt kommen, mit Ausnahme von Farbzusätzen. Vor Dezember 2022 mussten sich Kosmetikunternehmen überhaupt nicht bei der FDA registrieren. Nach dem Modernization of Cosmetic Regulations Act (MoCRA) müssen Unternehmen nun ihre Einrichtungen registrieren und ihre Produkte auflisten.
Vor der MoCRA stützte sich die FDA-Überwachung stark auf die Durchsetzung nach der Markteinführung und intervenierte, wenn Produkte als unsicher oder falsch gekennzeichnet befunden wurden. Mit der obligatorischen Registrierung hat die FDA nun eine bessere Sichtbarkeit, kann die Compliance proaktiv bewerten und Inspektionen basierend auf Risikoprofilen planen.
Es ist wichtig zu beachten, dass die Registrierung nicht mit der Genehmigung übereinstimmt. Der Irrglaube besteht weiterhin darin, dass die FDA-Registrierung auf die Befürwortung eines Produkts hinweist, wenn sie der FDA in der Tat einfach die Befugnis erteilt, die Einhaltung zu überprüfen und zu überwachen. Darüber hinaus können kosmetische Aussagen, die therapeutische Vorteile implizieren – wie die Heilung oder Prävention von Krankheiten – dazu führen, dass die FDA das Produkt als Medikament reguliert, was eine Zulassung erfordern kann.
Den Mythos aufbrechen: Die kosmetische Registrierung unter MoCRA bedeutet nicht, dass die FDA das Produkt zugelassen hat. Die Zulassung gilt nur für bestimmte Farbzusätze oder wenn das Produkt als Arzneimittel reguliert ist.
Eine wichtige Ausnahme zu diesem Nicht-Zulassungsmodell sind Farbzusätze – ob in Kosmetika, Lebensmitteln oder Arzneimitteln verwendet – die durch ihren eigenen Zulassungsprozess reguliert werden.
FDA-Zulassung von Farbadditiven
Die FDA muss Farbzusätze, die in Lebensmitteln, Arzneimitteln, Kosmetika und bestimmten Medizinprodukten verwendet werden, genehmigen. Diese Zulassung stellt sicher, dass der Zusatzstoff die Sicherheitsstandards für den vorgesehenen Verwendungszweck erfüllt. Bestimmte Hochrisikofarben erfordern vor der Verwendung eine Chargenzertifizierung für jedes Los.
Farbadditive dürfen nur gemäß ihren genehmigten Spezifikationen und Einschränkungen verwendet werden. Produkte, die nicht zugelassene Farbzusätze enthalten, gelten gemäß dem FD&C Act als verfälscht und können in US-Einreisehäfen verhaftet werden.
Den Mythos aufbrechen: Die Genehmigung eines Farbzusatzes für eine Verwendung erlaubt es nicht, ihn in anderen Produktkategorien zu verwenden. Jede zugelassene Verwendung hat spezifische Einschränkungen und Bedingungen.
Kennzeichnung von FDA-zugelassenen Produkten
Auch für zugelassene Produkte gibt es noch einen weiteren Bereich, der Hersteller in Gang bringt: die Etikettierung. Hersteller von Arzneimitteln und Geräten, die eine Genehmigung erfordern, können „FDA-zugelassen“ auf der Produktkennzeichnung angeben, wenn sie eine schriftliche Bestätigung von der Behörde erhalten haben. Das FDA-Logo darf jedoch nicht verwendet werden, da es eine Billigung impliziert und zu zivil- oder strafrechtlicher Haftung führen kann. Unabhängig vom Genehmigungsstatus müssen alle regulierten Einrichtungen die aktuellen guten Herstellungspraktiken (CGMPs) und Etikettierungsanforderungen erfüllen.
Für Produkte, die eine Zulassung oder Freigabe erfordern, wie z. B. bestimmte Medikamente und Geräte, überprüft und genehmigt die FDA auch die Kennzeichnung des Produkts als Teil des Prozesses. In den meisten anderen Fällen sind Etiketten jedoch nicht von der FDA vorab genehmigt.
Die FDA setzt die Einhaltung durch Anlageninspektionen, Produktproben und Versandprüfungen an der Grenze durch.
Arbeiten Sie mit der Registrar Corp. auf dem Weg zur FDA-Zulassung
Registrar Corp hilft Lebensmittel-, Getränke-, Arzneimittel-, Medizinprodukte- und Kosmetikunternehmen bei der Navigation durch die US-amerikanischen FDA-Vorschriften. Wir unterstützen Sie bei der Registrierung von Anlagen, der Produktliste, der Überprüfung von Etiketten und der Zertifizierung von Farbzusatzchargen. Das Handeln vor einer Compliance-Frist oder einer Durchsetzungsmaßnahme kann kostspielige Verzögerungen und den Verlust des Marktzugangs verhindern.
Um sofortige Unterstützung zu erhalten und sicherzustellen, dass Sie alle geltenden Anforderungen erfüllen, rufen Sie +1-757-224-0177 an oder sprechen Sie rund um die Uhr mit einem Regulatory Advisor.



