2023年12月29日の締め切りに間に合うよう、化粧品会社は新しいMoCRA(Mo Modernization of Cosmetics Regulation Act)要件を遵守する準備をしています。
FDAは、新しい電子提出ポータル、化粧品ダイレクト、構造化製品ラベリング(SPL)フォーマットに関するガイダンスを引き続き共有しています。
化粧品ダイレクトポータル
2023年9月、FDAは、新しい81ページの文書Electronic Submission Portal Screenshots for Cosmeticsをリリースしました。本文書は、MoCRAが要求する施設登録および化粧品リストのユーザージャーニーを提供します。
また、情報の送信時に発生する可能性のある検証の失敗も表示されます。
FDAは、MoCRAに何を期待するかについて業界を教育する素晴らしい仕事をしました。このプレビューは、企業がポータルへの提出を処理する能力があるか、それとも外部の専門知識が必要かを判断するのに役立ちます。
FDAは、新たに作成された電子提出ポータル(Cosmetics Direct)の草案および紙のフォームに関するコメントの受理を開始しました。コメントの提出期限は2023年10月18日でした。
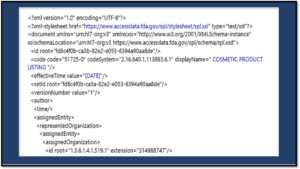
構造化製品ラベリング(SPL)フォーマットを見る
新しいCosmetics Directポータルでは、構造化された製品ラベリングソフトウェアの主要コンポーネントであるSPLフォーマットが強調されています。SPLフォーマットは、すべての化粧品の提出に必要です。SPL形式が新しいテリトリである化粧品会社の場合、例、XML形式、検証は複雑に見えることがあります。
スクリーンショットが公開される前は、業界が利用できる唯一の情報は、業界向けガイダンス草案でした。このガイダンスでは、SPL形式で登録データおよびリストデータを提出する必要があると述べ、以下の詳細を記載しました。
化粧品の施設登録と製品リストは、FDAに施設を登録し、医薬品をリストアップするために利用可能なのと同じ電子提出プロセスを使用して利用可能になります。これは、医薬品施設および上場情報も提出する事業体の化粧品施設および製品の登録および上場情報を提出するプロセスを合理化するのに役立ちます。
SPL実施ガイドおよびバリデーション手順
10月、FDAはSPLの実施と検証に関するガイドラインを発表しました。275ページのガイドでは、Cosmetics DirectをユーザーフレンドリーなSPLオーサリングツールとして説明しています。このツールでは、初回検証を実施し、SPL提出物を作成して保存し、FDAに提出します。
11月14日、FDAはSPL実施ガイドを更新し、SPLフレームワークに含まれる化粧品製品施設登録および製品リストへの追加更新を含めた。
今後のMoCRAコンプライアンス期限
FDAは、Cosmetics Direct提出ポータルの正確な開始日をまだ発表していません。しかし、施設が2023年12月29日の締め切りに間に合うように開始されます。
FDAは、2024年7月1日、または12月29日の締め切りから6か月後の施行日を遅らせたことを発表しました。この更新は、SPL提出の複雑さを認識し、化粧品施設が要件を遵守するための追加の時間を提供します。
この延長は、2022年12月29日以降に化粧品製品の製造または加工を開始した化粧品施設に適用されます。12月の締め切りまでに登録する代わりに、7月1日までに登録を完了する必要があります。
2022年12月29日以降に化粧品のマーケティングを開始した企業は、FDAがMoCRAリスト要件を施行する前にさらに6ヶ月がかかります。
レジストラ・コーポレーションがお手伝い
レジストラ・コーポレーションは、SPL形式でFDA医薬品リストを提出してきた豊富な経験を有しており、化粧品会社はレジストラ・コーポレーションを信頼して、MoCRAに基づくFDAの新しい化粧品要件を確実に遵守し、化粧品ダイレクトの提出を支援しています。
新しい化粧品ポータルをプレビューするドキュメント全体を表示し、新しい規制に準拠するためにレジストラが貴社にできることをご覧ください。


