FDAの承認が必要ですか? レジストラ社とのFDAコンプライアンスの達成
FDAの承認の取得方法を学ぶか、またはそれが必要かどうかを決定することは、米国で販売する予定の製品の種類に完全に依存します。多くの人は、市場に参入する前にすべての製品がレビューされ、承認される必要があると想定していますが、現実ははるかに微妙です。FDAは、市場に参入する前にすべての製品を承認することを要求しておらず、場合によっては、特定の成分などの特定の成分のみがプロセスを経る必要があります。これらの違いを誤解すると、コストのかかる遅延、ラベル表示違反、さらには強制措置につながる可能性があります。
十分な情報に基づいた意思決定を行うには、企業は単なる定義以上のものが必要です。つまり、規制経路、コンプライアンス違反の危険性、神話に基づいて行動した場合の結果を理解する必要があります。このガイドでは、FDAが規制する各主要製品カテゴリーについて、承認が必要な時期、不要な時期、および適用されるコンプライアンス手順について説明します。また、一般的な誤解に対処し、クイックリファレンスチャートを提供し、信頼できるFDAリソースへのリンクを提供します。1つの核となる真理は、FDAへの登録はFDAの承認と同じではなく、そうでなければ費用のかかる間違いになる可能性があります。
クイックリファレンス:FDAの承認および登録要件
| カテゴリー | FDAの承認が必要ですか? | 登録が必要ですか? | 主な例外 |
| 飲食 | いいえ | はい(ほとんどの施設) | 新しい食品添加物 |
| 栄養補助食品 | いいえ | はい(ほとんどの施設) | 疾病請求が薬物規制のトリガーとなる |
| 医薬品 | 時々 | はい | 準拠OTCモノグラフは承認を必要としません |
| 医療機器 | クラスIIIのみ | はい | 特定のクラスIおよびIIでは510(k)クリアランスが必要 |
| 化粧品 | いいえ(カラー添加剤を除く) | はい(MoCRAの下) | 構造/機能に影響を与えるという主張は、薬物規制を引き起こす可能性がある |
| 色添加剤 | はい | 該当なし | バッチ認証を必要とするものもあります |
FDAによる食品、飲料、および栄養補助食品の承認
一般的な信念とは対照的に、FDAは米国で販売される前に食品、飲料、または栄養補助食品を承認しません。食品施設は認証や市販前承認を必要としませんが、大半はFDAに登録し、食品安全近代化法(FSMA)に準拠する必要があります。
登録は2つの主な目的を果たします:FDAに定期的および緊急時のコミュニケーションに必要な連絡先情報を提供し、施設における製品と活動について当局に通知します。この情報により、FDAは、潜在的な食品安全リスクに基づいて検査の優先順位を設定し、無作為化されたチェックを実施しながら、高リスクのオペレーションに重点を置くことができます。例えば、すぐに食べられる食品を生産する施設は、低リスクの商品加工業者よりも頻繁に検査される場合がある。
FDAは、登録施設を検査し、違反の警告状を発行し、コンプライアンス違反と思われる貨物を拘留することにより、これらの要件を執行します。また、登録により、リコールや公衆衛生上の緊急事態の発生時に、的を絞ったアウトリーチが可能になります。しかし、ほとんどの食品およびサプリメント施設では登録が必要ですが、製品承認と混同しないでください。この区別は、FDAが規制するすべての業界において重要です。
さらに、FSMAは、予防管理有資格者(PCQI)が監督する食品安全プランの実施と維持を施設に義務付けています。認識されたPCQIトレーニングプログラムを完了すると、責任者が危険を特定し、管理策を検証し、コンプライアンスを管理する態勢を整えることができます。指定されたPCQIがない場合、企業は検査所見の解決において強制措置や遅延のリスクがあります。
このカテゴリーの例外の1つは食品添加物です。一般的に安全であると認識されない限り(GRAS)、新しい添加物は食品添加物の請願書を通じて承認される必要があり、FD&C法の下で厳格な試験と安全性データが必要です。
使用目的が重要:製品が栄養から治療クレームまで線を越えた場合、承認を必要とする新しい規制カテゴリーに完全に参入する可能性があります。例えば、病気の治療、診断、予防、または治癒を主張する栄養補助食品は、医薬品として規制され、次のセクションで概説される承認プロセスの対象となります。
神話に挑む:FDAが承認した食品は存在しません。施設が登録され、完全に準拠している場合でも、添加物などの特定の成分が承認プロセスを通過しない限り、施設もその製品も正式に承認されていません。
FDAによる医薬品の承認
新薬がFDAの承認を必要とするかどうかは、市販薬(OTC)モノグラフに適合するかどうかによって異なります。OTCモノグラフは、市販前承認なしに医薬品が安全かつ有効とみなされる特定の条件を詳述します。最終的なモノグラフは、成分、投与量、ラベル付け、および試験基準を指定して、薬剤カテゴリーの“レシピ”として機能します。FDAはまた、暫定的な最終モノグラフの下で特定の薬物について執行裁量権を行使する。
医薬品がOTCモノグラフに適合しない場合、市販前承認を受ける必要があります。このプロセスには、実験室分析、動物試験、段階的なヒト臨床試験が含まれ、その後FDAにデータを提出します。当局は、データをレビューし、意図された使用に対する利益がリスクを上回るかどうかを判断します。食品・医薬品・化粧品法(FD&C法)では、承認なしに不適合医薬品を販売することは禁止されています。FDAは配合剤を承認していない。
医薬品施設は、FDAに製品を登録してリストアップし、査察とコンプライアンス監視の監督を当局に与える必要があります。繰り返しになりますが、この登録および上場プロセスは、必要に応じて、FDAが医薬品または施設を承認したことを意味するものではありません。
医薬品と同様に、医療機器も段階的な市場参入経路をたどりますが、基準と承認の閾値は異なります。
神話に挑む:多くの人は、FDAが市販される前にすべての医薬品を承認しなければならないと考えています。実際には、医薬品がOTCモノグラフに適合している場合、市販前承認なしに合法的に市販することができます。
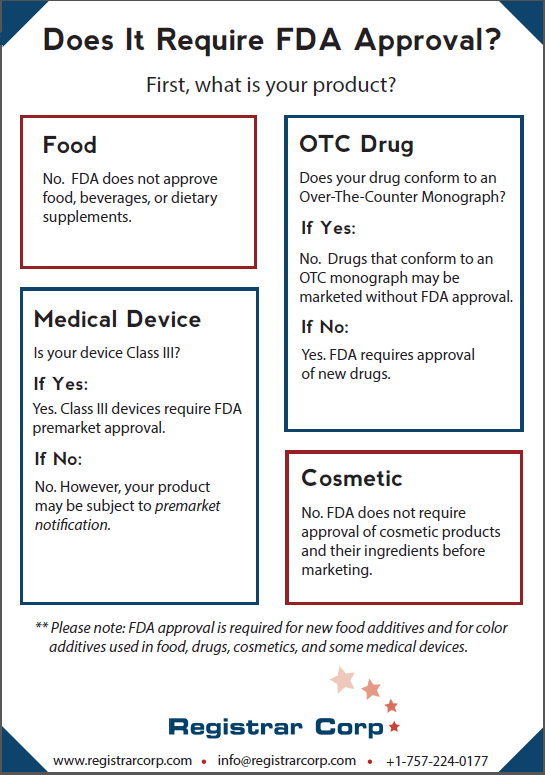
FDAによる医療機器の承認
FDAは、リスクに基づいて医療機器を3つのカテゴリーに分類しています。クラスI(低リスク)、クラスII(中リスク)、クラスIII(高リスク)。ペースメーカーや特定のインプラントなどのクラスIII機器には市販前承認が必要であり、臨床試験や技術文書を通じて安全性と有効性の確固たる証拠が求められます。
クラスIおよびIIの機器は、免除されない限り、法的に市販されている機器と実質的な同等性を示す市販前通知(510(k))を提出しなければならない。 これには、詳細な製品仕様、性能データ、時には臨床的証拠の提供が含まれます。FDA が同等性を判断する場合、承認するのではなく、市販の機器を \”許可\” します。他のカテゴリと同様に、機器の登録およびリスト要件はFDAが業界の活動を監視するのに役立ちますが、製品承認と同等ではありません。
神話に挑む:\”FDA認可\” と \”FDA認可\” は互換性がありません。FDAの審査対象のうち、ほとんどの機器は510(k)プロセスで認可され、承認されていません。クラスIIIデバイスのみ、市販前承認が必要です。
FDAによる化粧品の承認
FDAは、カラー添加剤を除き、化粧品またはその成分を市場に出る前に承認することを要求しません。2022年12月以前は、化粧品会社はFDAへの登録を全く要求されていなかった。化粧品規制近代化法(MoCRA)の下で、企業は施設を登録し、製品をリストする必要があります。
MoCRA以前は、FDAの監督は市販後の執行に大きく依存していました。これは、製品が安全でない、または誤ったブランドで発見された場合の介入です。現在、FDAは登録を義務付けているため、可視性が向上し、コンプライアンスを予防的に評価し、リスクプロファイルに基づいて検査をスケジュールすることができます。
登録は承認と同じではないことに注意してください。FDA 登録が製品の承認を示しているという誤解は、実際には単に FDA にコンプライアンスを検査および監視する権限を付与するだけであるという意味で、存続しています。さらに、病気の治癒や予防などの治療上の利益を示唆する美容上の主張は、FDAが医薬品として製品を規制する原因となり、承認が必要となる場合があります。
神話に挑む:MoCRAによる化粧品登録は、FDAが製品を承認したことを意味するものではありません。承認は、特定の着色添加物、または製品が医薬品として規制されている場合にのみ適用されます。
この非承認モデルの主な例外の1つは、化粧品、食品、または医薬品のいずれで使用されるかにかかわらず、独自の承認プロセスで規制されている着色添加物です。
FDAによる色添加剤の承認
FDAは、食品、医薬品、化粧品、および特定の医療機器に使用される色添加剤を承認する必要があります。この承認は、添加剤が意図された使用のための安全基準を満たしていることを保証します。特定の高リスク色では、使用前にロットごとにバッチ認証が必要です。
カラー添加剤は、承認された仕様および制限に従ってのみ使用できます。未承認の着色添加物を含む製品は、FD&C法の下では不浸透とみなされ、米国の入国港で拘禁される場合があります。
神話に挑む:1回の使用に対する色添加剤の承認は、他の製品カテゴリでの使用を許可しません。承認された各使用には、特定の制限と条件があります。
FDA承認製品のラベリング
承認された製品であっても、メーカーを跳ね返す別の分野があります。承認を必要とする医薬品および機器の製造業者は、当局から書面による確認を受領している場合、製品ラベルにFDA承認を含めることができます。ただし、FDAのロゴは、裏書を意味し、民事責任または刑事責任につながる可能性があるため、使用することはできません。承認ステータスにかかわらず、すべての規制対象施設は、現行の適正製造基準(CGMP)およびラベリング要件を遵守しなければなりません。
特定の医薬品や機器など、承認または認可が必要な製品については、FDAもプロセスの一環として製品のラベル表示を審査および承認します。しかし、ほとんどの場合、ラベルはFDAによって事前に承認されていません。
FDAは、国境での施設検査、製品サンプリング、および出荷チェックを通じてコンプライアンスを強制します。
レジストラ社とのFDA承認に向けた取り組み
レジストラは、食品、飲料、医薬品、医療機器、化粧品の企業が米国FDAの規制をナビゲートするのを支援します。当社は、施設登録、製品リスト、ラベルレビュー、および色添加剤バッチ認証を支援します。コンプライアンスの期限や強制措置の前に行動することで、コストのかかる遅延や市場アクセスの喪失を防ぐことができます。
直ちにサポートを受け、該当するすべての要件を満たせるようにするには、+1-757-224-0177に電話するか、24時間365日、規制アドバイザーとチャットしてください。



